题目内容
(1)某学生用0.2000mol/L NaOH溶液滴定20.00mL未知浓度的盐酸溶液,几次滴定消耗NaOH溶液的体积如下:
则该盐酸溶液的准确浓度为 mol/L.(保留小数点后4位)
(2)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
| 实验序 号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(2)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是:
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液.
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:(1)先根据数据的有效性,舍去第3组数据,然后求出1、2、4组平均消耗V(NaOH),接着根据c(待测)=
来计算;
(2)根据c(待测)=
分析不当操作对V(标准)×的影响,以此判断浓度的误差.
| V(标准)×c(标准) |
| V(待测) |
(2)根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
解答:
解:(1)第3组数据误差较大,舍去,则第1、2、4组平均消耗V(NaOH)=
=20.00mL,
c(待测)=
=
=0.2000 mol/L;
故答案为:0.2000;
(2)A、碱式滴定管未润洗就装标准液滴定,造成消耗的V(标准)偏大,根据c(待测)=
,可知c(待测)偏大,即造成测定结果偏高,故A正确;
B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致V(标准)偏小,则结果偏低,故B错误;
C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故C错误;
D、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成消耗的V(标准)偏大,所以c(待测)偏大,即造成测定结果偏高,故D正确;
故答案为:AD.
| 20.05+20.00+19.95 |
| 3 |
c(待测)=
| V(标准)×c(标准) |
| V(待测) |
| 0.2000mol/L×0.02000L |
| 0.02000L |
故答案为:0.2000;
(2)A、碱式滴定管未润洗就装标准液滴定,造成消耗的V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
B、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致V(标准)偏小,则结果偏低,故B错误;
C、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故C错误;
D、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成消耗的V(标准)偏大,所以c(待测)偏大,即造成测定结果偏高,故D正确;
故答案为:AD.
点评:本题考查了酸碱中和滴定、误差分析,题目难度不大,注重了中和滴定的基础知识考查,要求学生掌握中和滴定的方法.

练习册系列答案
相关题目
反应:aX(g)+bY(g)?cZ(g),达到平衡时测得X气体的浓度为1mol/L,在恒温下将该容器体积扩大一倍,再次达到平衡时,测得X气体的浓度为0.6mol/L,则下列叙述正确的是( )
| A、a+b<c |
| B、平衡向生成Z的方向移动 |
| C、Z的体积分数降低 |
| D、Y的转化率升高 |
下列关于铜、铝、铁的说法,正确的是( )
| A、三种金属常温下均不溶于足量的浓硝酸中 |
| B、三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C、三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D、三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
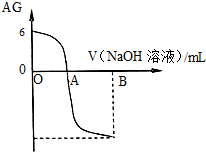 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
下列实验操作或有关叙述正确的是( )
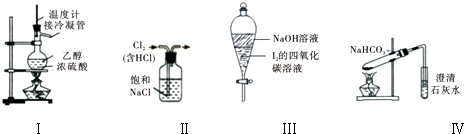

| A、用装置Ⅰ在实验室制备少量乙烯 |
| B、用装置Ⅱ来除去氯气中含有的HCl气体 |
| C、装置Ⅲ中,充分振荡后静置,下层溶液颜色保持不变 |
| D、用装置Ⅳ来探究NaHCO3的热稳定性 |