题目内容
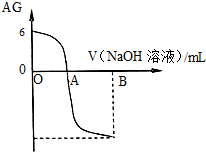 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol/L的醋酸溶液pH=4 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、根据A点时,AG=0,即
=1来分析;
B、根据图象可知,0.01 mol/L的醋酸溶液的AG=6来计算;
C、根据在OA段中,CH3COOH与NaOH 反应的情况来分析;
D、B点时加入NaOH溶液40 mL,得等浓度的CH3COONa和NaOH的混合溶液,根据溶液的电荷守恒和物料守恒来分析.
| C(H+) |
| C(OH-) |
B、根据图象可知,0.01 mol/L的醋酸溶液的AG=6来计算;
C、根据在OA段中,CH3COOH与NaOH 反应的情况来分析;
D、B点时加入NaOH溶液40 mL,得等浓度的CH3COONa和NaOH的混合溶液,根据溶液的电荷守恒和物料守恒来分析.
解答:
解:A、A点时,AG=0,即
=1,则溶液呈中性;由于醋酸是弱酸,而要使溶液呈中性,加入氢氧化钠溶液体积应小于20 mL,故A错误;
B、根据图象可知,0.01 mol/L的醋酸溶液的AG=6,即
=106,而常温下,水的离子积Kw=c(H+)?c(OH-)=10-14,解得c(H+)=10-4mol/L,则pH=4,故B正确;
C、在OA段中,当靠近O点时,CH3COOH与NaOH后,CH3COOH大量过量,得大量CH3COOH和极少量CH3COONa的混合溶液,在此混合溶液中,c(CH3COO-)<c(CH3COOH),故C错误;
D、B点时加入NaOH溶液40 mL,得等浓度的CH3COONa和NaOH的混合溶液,根据溶液的电荷守恒和物料守恒列式可有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)①
2c(CH3COO-)+2 c(CH3COOH)=c(Na+)②
将②带入①中可得:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-),故D正确.
故选AC.
| C(H+) |
| C(OH-) |
B、根据图象可知,0.01 mol/L的醋酸溶液的AG=6,即
| C(H+) |
| C(OH-) |
C、在OA段中,当靠近O点时,CH3COOH与NaOH后,CH3COOH大量过量,得大量CH3COOH和极少量CH3COONa的混合溶液,在此混合溶液中,c(CH3COO-)<c(CH3COOH),故C错误;
D、B点时加入NaOH溶液40 mL,得等浓度的CH3COONa和NaOH的混合溶液,根据溶液的电荷守恒和物料守恒列式可有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)①
2c(CH3COO-)+2 c(CH3COOH)=c(Na+)②
将②带入①中可得:c(CH3COO-)+2 c(CH3COOH)+c(H+)=c(OH-),故D正确.
故选AC.
点评:本题考查了酸碱中和滴定中的pH的有关计算和离子浓度大小比较,应注意的是AG的计算公式,当AG=0时,溶液呈中性.

练习册系列答案
相关题目
下列实验误差分析错误的是( )
| A、用容量瓶配制溶液时,定容时仰视刻度线,所配溶液浓度偏小 |
| B、用润湿的pH试纸测溶液的pH,所测pH不一定有误差 |
| C、测定中和反应的反应热时,将碱分多次倒入酸中,所测△H偏小 |
| D、酸碱中和滴定时,滴定前盛装标准液的滴定管内有气泡,终点读数时气泡消失,所测结果偏大 |
下列叙述不正确的是( )
| A、除去NO中混有的NO2:用水洗气 |
| B、Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
| C、加入新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 |
| D、向某溶液中先加入硝酸,后再加入BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- |

 已知A为淡黄色固体,E、D为两种常见的用途很广的金属单质,H的溶液中含有两种金属阳离子,I不溶于水.
已知A为淡黄色固体,E、D为两种常见的用途很广的金属单质,H的溶液中含有两种金属阳离子,I不溶于水.