题目内容
12.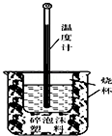 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:(1)该组同学共设计出以下3种测定方案,通过测定反应过程中释放的热量来计算反应热(△H中和)
A.测定0.5mol/L的HCl溶液50ml与0.55mol•L-1的NaOH溶液50ml所放出的热量
B.测定0.55mol/L的HCl溶液50ml与0.5mol•L-1的NaOH溶液50ml所放出的热量
C.测定0.5mol/L的HCl溶液50ml与0.5mol•L-1的NaOH溶液50ml所放出的热量
请选出合理的方案AB.不合理方案的原因为若碱(或酸)不过量,则难以保证H+(或OH-)充分反应生成水.
(2)该图中有两处未画出,它们是环形玻璃搅拌棒;烧杯上方盖硬纸板
(3)用50mL 0.50mol•L-1盐酸和50mL 0.60mol•L-1 NaOH溶液反应,实验中测得起始温度为22.1℃,终止温度为25.4℃,反应后溶液的比热容为4.18J•g-1•℃-1,盐酸和NaOH溶液的密度都近似认为是1g•cm-3,测出△H=-55.2kJ/mol
(4)如果用0.50mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的热值将偏大(填“偏大”、“偏小”或“不变”),用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”).
分析 (1)为了保证H+(或OH-)充分反应生成水,酸或碱溶液需要过量,据此进行判断;
(2)根据量热计的构造来判断该装置的缺少仪器;根据中和热测定实验成败的关键是保温工作;
(3)根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)氢氧化钠固体溶于水放出热量;氨水为弱碱,一水合氨的电离过程中会吸收热量.
解答 解:(1)A.测定0.5mol/L的HCl溶液50mL与0.55mol•L-1的NaOH溶液50mL所放出的热量,氢氧化钠溶液过量,可以保证氢离子完全反应,该方案合理,故A正确;
B.测定0.55mol/L的HCl溶液50mL与0.5mol•L-1的NaOH溶液50mL所放出的热量,盐酸过量,可以保证氢氧根离子完全反应,该方案合理,故B正确;
C.测定0.5mol/L的HCl溶液50mL与0.5mol•L-1的NaOH溶液50mL所放出的热量,不能保证氢离子或氢氧根离子完全反应,该方案不合理,故C错误;
根据分析可知,合理的方案为AB,C不合理,原因是若碱(或酸)不过量,则难以保证H+(或OH-)充分反应生成水,
故答案为:AB;若碱(或酸)不过量,则难以保证H+(或OH-)充分反应生成水;
(2)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,为了减少热量的损失,烧杯上方盖硬纸板;
故答案为:环形玻璃搅拌棒;烧杯上方盖硬纸板;
(3)用50mL 0.50mol•L-1盐酸和50mL 0.55mol•L-1 NaOH溶液反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=3.3℃,则生成0.025mol水放出的热量为:Q=m•c•△T=100g×4.18J/(g•℃)×3.3℃=1379.4J,即1.3794KJ,
所以实验测得的中和热△H=-$\frac{1.3794kJ}{0.025mol}$=-55.2kJ/mol,
故答案为:-55.2 kJ/mol;
(4)氢氧化钠固体溶于水放热,反应后温度偏高,计算所得热量偏大,所以实验中测得的“中和热”数值将偏大;一水合氨的电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,即中和热的数值会偏小,
故答案为:偏大;偏小.
点评 本题考查了中和热的测定方法,题目难度中等,明确中和热的测定步骤为解答关键,注意掌握中和热计算方法,试题培养了学生的分析能力及化学实验能力.

| A. | 熔融态的A中阴离子有2种 | |
| B. | C溶于水会促进水的电离 | |
| C. | 将A溶液滴入B溶液中,能使B溶液中阳离子浓度增大 | |
| D. | B溶液的焰色反应呈黄色 |
| A. |  浓硫酸稀释 | B. |  除去氯气中氯化氢 | ||
| C. |  点燃 | D. |  转移溶液 |
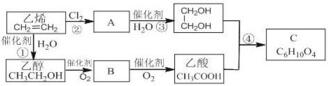
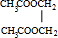 +2H2O.
+2H2O. )与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
)与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空: 或
或 .
. .
. 与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为
与氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色.A的结构简式为 .由A生成对溴苯乙烯的反应条件为浓硫酸、加热.
.由A生成对溴苯乙烯的反应条件为浓硫酸、加热.