题目内容
20.砷(As)与其化合物被广泛应用在除草剂、杀虫剂以及含砷药物中.回答下列问题:(1)砷是氮的同族元素.砷在元素周期表中的位置为第四周期第VA族;AsH3分子的空间构型为三角锥形.
(2)As2O3俗称砒霜,与锌和硫酸混合,会发生反应生成砷化氢、硫酸锌和水,该反应的化学方程式:As2O3+6H2SO4+6Zn=6ZnSO4+2ASH3↑+3H2O
As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式:As2O3+6OH-=2AsO33-+3H2O
(3)砷在自然界中主要以硫化物矿形式存在,如雄黄(As4S4)和雌黄(As2S3).As2S3和SnCl2在盐酸中反应转化为雄黄和SnCl4并有H2S气体放出.若二者恰好完全反应,As2S3和SnCl2的物质的量之比为:1:1,反应产生的气体可用氢氧化钠溶液吸收.
(4)As2O3和HNO3反应:As2O3+10H++10NO3-═2H3AsO4+3S↓+10NO↑+2H2O
将该反应设计成原电池,则NO2应该在正极(填“正极”或“负极”)附近逸出,该极的电极反应式为:NO3-+e-+2H+=NO2↑+H2O.
分析 (1)As与N同主族位于第VA族,As位于第四周期;其氢化物的结构与氨气相同;
(2)As2O3与锌和硫酸混合发生反应生成砷化氢、硫酸锌和水;As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水;
(3)根据反应物和生成物来分析反应,则利用氧化还原反应反应中得失电子守恒来分析完全反应的物质的量之比来解答;硫化氢可以用氢氧化钠溶液吸收;
(4)NO3-在正极上得电子生成NO2.
解答 解:(1)As与N同主族位于第VA族,As位于第四周期,即As位于第四周期第VA族;其氢化物的结构与氨气相同,则AsH3分子的空间构型为三角锥形;
故答案为:第四、第VA;三角锥形;
(2)As2O3与锌和硫酸混合发生反应生成砷化氢、硫酸锌和水,其反应的方程式为:As2O3+6H2SO4+6Zn=6ZnSO4+2ASH3↑+3H2O;As2O3与足量氢氧化钠溶液反应生成亚砷酸钠和水,其反应的离子方程式为:As2O3+6OH-=2AsO33-+3H2O;
故答案为:As2O3+6H2SO4+6Zn=6ZnSO4+2ASH3↑+3H2O;As2O3+6OH-=2AsO33-+3H2O;
(3)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,则反应为2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S,
根据电子得失守恒知1molAs2S3作氧化剂得到2mol电子,而1molSnCl2作还原剂失去2mol电子,则二者的物质的量之比是1:1;硫化氢溶于水显酸性,可以用氢氧化钠溶液吸收;
故答案为:1:1;氢氧化钠溶液;
(4)As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O反应中NO3-得到电子,正极上得电子的物质发生还原反应,所以NO3-在正极上得电子生成NO2,其电极方程式为:NO3-+e-+2H+=NO2↑+H2O;
故答案为:正极;NO3-+e-+2H+=NO2↑+H2O.
点评 本题考查了元素周期表的结构与元素周期律、氧化还原反应、离子方程式的书写、原电池原理的应用,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意掌握氧化还原反应中电子守恒在计算中的应用方法.

| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀. 请回答下列问题.
(1)Ⅰ中产生气体的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是SiO2.
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是Fe2+;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是向酸性KMnO4溶液中滴加待测液,褪色.
(4)Ⅳ中加NaClO的目的是将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀.
(5)由上述实验可以获得结论:原样品所有可能的成分组合为组合1:Al、Fe2O3、Cu2O;组合2:Al、Cu2O、Fe3O4(Al、Fe2O3、Cu2O、Fe3O4); …(用化学式表示,空不够可以补充.)
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
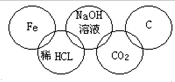 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
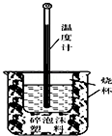 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题: