题目内容
1.下列实验装置或操作正确的是( )| A. |  浓硫酸稀释 | B. |  除去氯气中氯化氢 | ||
| C. |  点燃 | D. |  转移溶液 |
分析 A.稀释浓硫酸,将浓硫酸注入水中;
B.HCl极易溶于水,食盐水抑制氯气的溶解;
C.酒精灯不能用另一只酒精灯引燃;
D.转移液体需要引流.
解答 解:A.稀释浓硫酸,将浓硫酸注入水中,图中操作试剂顺序不合理,故A错误;
B.HCl极易溶于水,食盐水抑制氯气的溶解,除杂时导管长进短出,装置合理,故B正确;
C.酒精灯不能用另一只酒精灯引燃,应利用火柴点燃,故C错误;
D.转移液体需要引流,图中缺少玻璃棒引流,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、仪器使用、溶液配制及实验技能等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.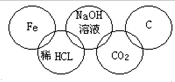 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
6.下列反应属于吸热反应的是( )
| A. | 浓硫酸溶于水 | B. | 钠与水反应 | C. | 生石灰溶于水 | D. | 氯化铵加热分解 |
13.下列物质不属于硅酸盐产品的是( )
| A. | 水晶 | B. | 有色玻璃 | C. | 青花瓷 | D. | 水泥 |
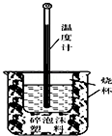 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题: