题目内容
某碱厂电解饱和食盐水制取烧碱溶液的工艺流程如图所示:
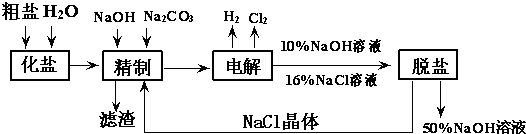
完成下列填空:
(1)写出总的电解化学方程式
(2)写出实验室制取阳极气体产物的离子方程式
(3)工业食盐中含Ca2+、Mg2+等杂质离子,精制过程中发生的离子方程式 ;
(4)如果粗盐中SO42-含量较高,必须添加钡试剂除去,该钡试剂可以是
a.Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(5)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序是
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
d.先加Na2CO3,后加NaOH,再加钡试剂
(6)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填操作名称)除去NaCl.

完成下列填空:
(1)写出总的电解化学方程式
(2)写出实验室制取阳极气体产物的离子方程式
(3)工业食盐中含Ca2+、Mg2+等杂质离子,精制过程中发生的离子方程式
(4)如果粗盐中SO42-含量较高,必须添加钡试剂除去,该钡试剂可以是
a.Ba(OH)2溶液 b.Ba(NO3)2溶液 c.BaCl2溶液
(5)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序是
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
d.先加Na2CO3,后加NaOH,再加钡试剂
(6)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
考点:电解原理,工业制烧碱
专题:实验设计题,元素及其化合物
分析:(1)根据图可看出电解氯化钠溶液的生成物,配平即可;
(2)电解饱和食盐水,在阳极上产生氯气;实验室中用二氧化锰和浓盐酸来制取氯气;
(3)Ca2+、Mg2+等杂质离子可以分别用碳酸钠、氢氧化钠除去;
(4)除杂时不能向溶液中引进杂质离子;
(5)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(6)根据氯化钠的溶解度随温度变化不大的特征进行解答.
(2)电解饱和食盐水,在阳极上产生氯气;实验室中用二氧化锰和浓盐酸来制取氯气;
(3)Ca2+、Mg2+等杂质离子可以分别用碳酸钠、氢氧化钠除去;
(4)除杂时不能向溶液中引进杂质离子;
(5)根据除去钙离子用碳酸根离子进行沉淀,除去镁离子用氢氧根离子进行沉淀,除去硫酸根离子用钡离子沉淀,过量的钡离子需要用碳酸根离子除去进行分析;
(6)根据氯化钠的溶解度随温度变化不大的特征进行解答.
解答:
解:(1)电解氯化钠溶液的生成物有氢氧化钠、氯气以及氢气,反应原理为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(2)电解饱和食盐水,在阳极上产生氯气,实验室中用二氧化锰和浓盐酸来制取氯气,反应的实质是:2Cl-+MnO2+4H+
Mn2++Cl2↑+2H2O,
故答案为:2Cl-+MnO2+4H+
Mn2++Cl2↑+2H2O;
(3)Ca2+、Mg2+等杂质离子可以分别用碳酸钠、氢氧化钠除去,精制过程发生反应的离子方程式为Ca2++CO32-=CaCO3↓、Mg2++OH-=Mg (OH)2↓,
故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(4)除去硫酸根离子的同时不能引入新的离子,而氯离子和氢氧根离子原溶液中本身就含有,故钡试剂可以是Ba(OH)2或BaCl2,故答案为:ac;
(5)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,
故答案为:bc;
(6)由氯化钠的溶解度随温度变化不大的特征,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、过滤除去NaCl;故答案为:加热蒸发;过滤.
| ||
| ||
(2)电解饱和食盐水,在阳极上产生氯气,实验室中用二氧化锰和浓盐酸来制取氯气,反应的实质是:2Cl-+MnO2+4H+
| ||
故答案为:2Cl-+MnO2+4H+
| ||
(3)Ca2+、Mg2+等杂质离子可以分别用碳酸钠、氢氧化钠除去,精制过程发生反应的离子方程式为Ca2++CO32-=CaCO3↓、Mg2++OH-=Mg (OH)2↓,
故答案为:Ca2++CO32-=CaCO3↓;Mg2++OH-=Mg (OH)2↓;
(4)除去硫酸根离子的同时不能引入新的离子,而氯离子和氢氧根离子原溶液中本身就含有,故钡试剂可以是Ba(OH)2或BaCl2,故答案为:ac;
(5)加入的钡离子可以由碳酸钠除去,故最后加碳酸钠,钡试剂与氢氧化钠先后都可,故加入试剂的顺序为先加NaOH,后加钡试剂,再加Na2CO3或先加钡试剂,后加NaOH,再加Na2CO3,
故答案为:bc;
(6)由氯化钠的溶解度随温度变化不大的特征,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、过滤除去NaCl;故答案为:加热蒸发;过滤.
点评:本题重点考查了食盐水的精制、电解池的电解原理及电极反应离子方程式的书写的知识,是一道综合知识的考查,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目
标准状况下,下列物质体积最大的是( )
| A、2g H2 |
| B、20g SO2 |
| C、100个O2 |
| D、56g Fe |
下列与有机物结构、性质相关的叙述错误的是( )
| A、乙醇分子中含有羟基,能发生氧化反应、取代反应、加成反应 |
| B、乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| C、甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 |
| D、乙烯和苯都能发生加成反应 |
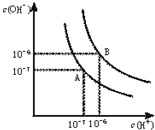 (1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(1)水的电离平衡曲线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
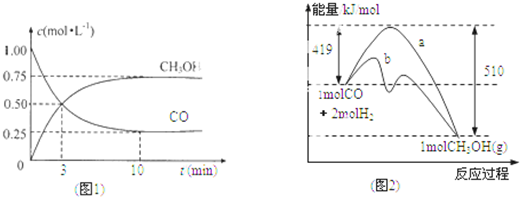
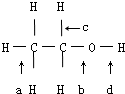 ,判断发生反应其所断裂的键.
,判断发生反应其所断裂的键.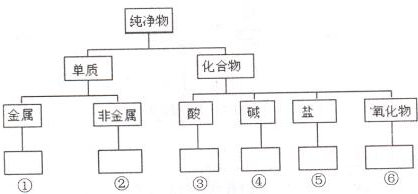 在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内:
在化学研究中,化学家常常先对物质进行分类,以便对同类物质的组成和性能进行深入的研究,请你将下列物质N2、HClO、CuO、KOH、NaHCO3、Fe3O4、Mg、S的正确分类填入相应的方框内: