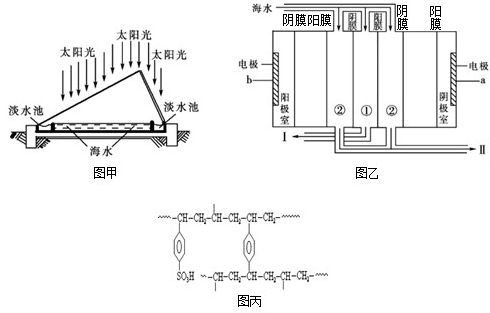
题目内容
CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业.工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
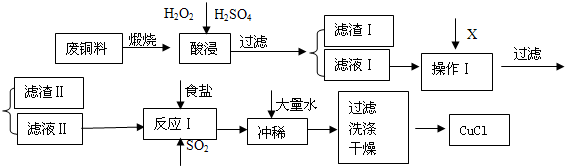
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀.
(1)煅烧的主要目的是 .
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 .
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: .
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: .
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O?CuOH+H+的平衡常数为 .

已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀.
(1)煅烧的主要目的是
(2)操作Ⅰ为调节溶液的PH值,范围为
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式:
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是:
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O?CuOH+H+的平衡常数为
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)煅烧的主要目的是使铜转化为可溶于酸的氧化物,因为铜与稀硫酸不反应;
(2)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀,由表中数据可知,所以需要调节pH的范围为4.7≤pH<5.6;
(3)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀;
(4)根据题目信息:CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸;
(5)升高温度或增大反应物的浓度能加快反应速率;
(6)根据Cu++H2O?CuOH+H+的平衡常数k=
=
=
=1.
(2)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀,由表中数据可知,所以需要调节pH的范围为4.7≤pH<5.6;
(3)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀;
(4)根据题目信息:CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸;
(5)升高温度或增大反应物的浓度能加快反应速率;
(6)根据Cu++H2O?CuOH+H+的平衡常数k=
| c(H+) |
| c(Cu+) |
| kw |
| ksp |
| 10-14 |
| 10-14 |
解答:
解:(1)铜与稀硫酸不反应,煅烧的主要目的是使铜转化为可溶于酸的氧化物,故答案为:使铜转化为可溶于酸的氧化物;
(2)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀,由表中数据可知,所以需要调节pH的范围为4.7≤pH<5.6,A、CuO B、Cu(OH)2 C、NaOH 溶液可以和酸反应,故答案为:4.7≤pH<5.6;ABC;
(3)滤渣Ⅱ的主要成分是Fe(OH)3和Al(OH)3,故答案为:Fe(OH)3和Al(OH)3;
(4)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和铜离子发生氧化还原反应,反应方程式为2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+,故答案为:2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+;
(5)升高温度或增大反应物的浓度能加快反应速率,所以温度升至70~80℃,并使用NaCl浓溶液,目的是提高CuCl2-的生成速率,
故答案为:提高CuCl2-的生成速率;
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O?CuOH+H+的平衡常数k=
=
=
=1,故答案为:1.
(2)加入X与酸反应调节PH使三价铁离子和铝离子完全沉淀,而铜离子不能沉淀,由表中数据可知,所以需要调节pH的范围为4.7≤pH<5.6,A、CuO B、Cu(OH)2 C、NaOH 溶液可以和酸反应,故答案为:4.7≤pH<5.6;ABC;
(3)滤渣Ⅱ的主要成分是Fe(OH)3和Al(OH)3,故答案为:Fe(OH)3和Al(OH)3;
(4)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和铜离子发生氧化还原反应,反应方程式为2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+,故答案为:2Cu2++SO2+4Cl-+2H2O=2CuCl2-+SO42-+4H+;
(5)升高温度或增大反应物的浓度能加快反应速率,所以温度升至70~80℃,并使用NaCl浓溶液,目的是提高CuCl2-的生成速率,
故答案为:提高CuCl2-的生成速率;
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O?CuOH+H+的平衡常数k=
| c(H+) |
| c(Cu+) |
| kw |
| ksp |
| 10-14 |
| 10-14 |
点评:考查学生对元素及其化合物的主要性质的掌握、书写离子方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
除去括号内杂质所用试剂和方法,正确的是( )
| A、乙醇(乙酸):生石灰,过滤 |
| B、苯(苯酚):溴水,过滤 |
| C、乙酸乙酯(乙酸):氢氧化钠溶液,分液 |
| D、乙烷(乙烯):溴水,洗气 |
关于如图所示装置的叙述,正确的是( )


| A、铜是负极,铜片上有气泡产生 |
| B、铜片质量逐渐减少 |
| C、锌片质量逐渐减少 |
| D、电流从锌片经导线流向铜片 |