题目内容
9.用NA表示阿伏加德罗常数的数值,则下列说法中不正确的是( )| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
分析 A、求出混合气体的物质的量,然后根据分子个数N=nNA来计算;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
D、二氧化碳所处的状态不明确.
解答 解:A、aL混合气体的物质的量为n=$\frac{a}{22.4}$mol,故分子个数N=nNA=$\frac{a}{22.4}{N}_{A}$个,故A正确;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故B正确;
C、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠反应后失去0.1NA个电子,故C正确;
D、二氧化碳所处的状态不明确,故其物质的量无法计算,故D错误.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
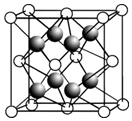
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
④写出Cu原子核外电子排布式[Ar]3d104s1;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
14.下列离子方程式,正确的是( )
| A. | 铜与盐酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 锌与硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
1.下列各离子能大量共存的是( )
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
10.(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:
则依据表中数据,该NaOH溶液的物质的量浓度为0.1044mol•L-1.
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度.用甲基橙作指示剂,下列操作可能使测定结果偏低的是C.
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖咀部份有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管.(填仪器名称)
11.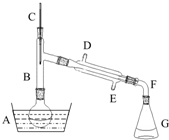 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
CH3CH2OH+HBr $\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
请回答下列问题.
(1)加入药品之前须做的操作是检查装置的气密性.
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃;冷却水的流向应为E进D出(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO2和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是SO2+2OH-=SO32-+H2O、Br2+2OH-=Br-+BrO-+H2O.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了防止溴化氢气体的挥发.
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBr
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:NaBr+H2SO4=NaHSO4+HBrCH3CH2OH+HBr $\stackrel{硫酸}{→}$CH3CH2Br+H2O
某课外小组欲在实验室制备溴乙烷的装置如图.数据如下表.
| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
(1)加入药品之前须做的操作是检查装置的气密性.
(2)仪器B的作用是除了使溴乙烷馏出,还有一个目的是冷凝回流.温度计的温度应控制在38.4℃~78.5℃;冷却水的流向应为E进D出(填“D进E出”或“E进D出”)
(3)反应时有可能生成SO2和一种红棕色气体,可选择NaOH溶液分别除去这些气体,有关的离子方程式是SO2+2OH-=SO32-+H2O、Br2+2OH-=Br-+BrO-+H2O.
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应(如避免HBr被氧化),另一方面是为了防止溴化氢气体的挥发.
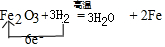 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.