题目内容
7.下列有关实验原理或实验操作正确的是( )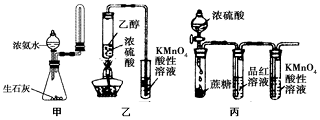
| A. | 实验室用图甲所示装置制取少量氨气 | |
| B. | 为使100ml0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50ml水 | |
| C. | 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 | |
| D. | 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
分析 A.气体收集装置不能密封;
B.100mL溶液蒸发掉50g水,剩余溶液体积未知,不能计算物质的量浓度;
C.挥发出来的乙醇也能够使酸性高锰酸钾溶液褪色,干扰了检验结果;
D.浓硫酸使蔗糖变黑,然后C与浓硫酸反应生成二氧化硫,二氧化硫能够漂白品红溶液,还能够与高锰酸钾发生氧化还原反应.
解答 解:A.收集氨气的试管不能密封,否则无法收集氨气,故A错误;
B.蒸发掉50g水后,剩余溶液未告诉密度,无法计算溶液的体积,则无法计算所得溶液的浓度,故B错误;
C.乙醇易挥发,挥发出的乙醇干扰了乙烯的检验,应该先用水除去乙醇,故C错误;
D.浓硫酸使蔗糖变黑,可知浓硫酸的脱水性,然后C与浓硫酸反应生成二氧化硫,二氧化硫能够使品红溶液褪色,证明二氧化硫检验漂白性;二氧化硫与高锰酸钾发生氧化还原反应,高锰酸钾褪色可知二氧化硫具有还原性,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,题目难度中等,涉及溶液配制、物质制备及性质实验等,把握实验技能、实验原理及实验装置为解答的关键,侧重分析与实验能力的考查.

练习册系列答案
相关题目
20.常温下,对于1L0.1mol/L的醋酸溶液,下列判断不正确的是( )
| A. | 该溶液的PH大于1 | |
| B. | c(OH-)=c(H+)-C(CH3COO-) | |
| C. | 与等体积、等浓度的NaOH溶液完全中和后,溶液显中性 | |
| D. | 与足量锌反应比等体积、等浓度的盐酸反应速率慢,生成氢气的质量相等 |
1.已知:在一定条件下,含高价态锰元素的化合物能被Cl-还原为Mn2+,氧化产物为Cl2,将1.0mol KMnO4加热,生成标准状况下5.6L气体后停止加热,向残留固体中加入足量浓盐酸,在加热条件下充分反应,又生成b mol气体,则b等于( )
| A. | 2 | B. | 1 | C. | 0.5 | D. | 0.25 |
16.下列说法不正确的是( )
| A. | 利用浓硫酸的吸水性,干燥氢气 | |
| B. | 碳酸氢钠溶液呈碱性,可用于治疗胃酸过多 | |
| C. | 氯化铝是电解质,电解熔融的氯化铝制备金属铝 | |
| D. | 镁在空气中燃烧时发出耀眼的白光,可用于制造信号弹 |
3.常温下,下列各组离子能在指定溶液中大量共存的是( )
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
12.a、b、c、d为短周期元素,a的M电子层有1个电子,b的一种核素14b常用于鉴定文物年代,c的最高价化合物与最低价化合物代数和为4,d的低价含氧酸能杀菌、消毒、漂白.下列叙述不正确的是( )
| A. | 最高价含氧酸酸性:d>c>b | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | b与氢形成的化合物只存在极性共价键 | |
| D. | a、b、c的离子半径依次增大 |
19.下列物质的水溶液因水解呈碱性的是( )
| A. | HCl | B. | NaOH | C. | CH3COONa | D. | Na2SO4 |
16.某工业废水中仅含下表离子中的5种:
某同学欲探究废水的组成,进行了如下实验:
Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
下列推断不正确的是( )
| 阳离子 | K+、Cu2+、Fe3+、Ca2+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
Ⅰ.取废水少许加入足量盐酸,无白色沉淀析出,但生成能使澄清石灰水变浑浊的无色无味气体
Ⅱ.向Ⅰ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
下列推断不正确的是( )
| A. | 溶液中一定含有的离子是K+、Cl-、CO32-、NO3-、SO42- | |
| B. | Ⅰ中加入盐酸生成无色气体的离子方程式是CO32-+2H+═CO2↑+H2O | |
| C. | 原溶液中的K+、Cl-、NO3-存在与否无法确定 | |
| D. | Ⅱ中产生白色沉淀的离子方程式是Ba2++SO42-═BaSO4↓ |
17.已知1~20号元素的离子,aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列说法正确的是( )
| A. | 质子数:d>c>b>a | B. | 离子半径:W2+>X+>Y2->Z- | ||
| C. | 原子半径:Z<Y<W<X | D. | 最低负价:X<W<Z<Y |