题目内容
5. 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)═N2H4(l)△H=+50.6kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则①N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622.2kJ•mol-1
②N2(g)+2H2(g)═N2H4(l) 不能自发进行的原因是△H>0,△S<0.
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是NaClO+2NH3═N2H4+NaCl+H2O.
(2)采矿废液中的CN- 可用H2O2处理.已知:H2SO4═H++HSO4-; HSO4-?H++SO42-.
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2.写出阳极上的电极反应式2HSO4--2e-═S2O82-+2H+.
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O?Mg(OH)2 Mg(OH)2+2NH4+?Mg2++2NH3•H2O.
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是升高温度NH3的溶解度降低,有利于NH3的逸出.
②剩余的氧化镁,不会对废水形成二次污染,理由是氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染.
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol•L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.则水样中氮的含量是2800cVmg•L-1(用含c、V的表达式表示).
分析 (1)①依据热化学方程式和盖斯定律来计算得到;
②依据△H-T△S<0判断反应自发进行;
③次氯酸钠氧化氨气,可以得到N2H4,依据氧化还原反应电子守恒、原子守恒配平写出;
(2)电解池中阴离子在阳极失电子发生氧化反应;
(3)①依据氨气溶解度随温度增大减小分析;
②氧化镁是难溶物质;
(4)依据滴定实验步骤和滴定用量结合化学方程式计算分析得到.
解答 解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式为:NaClO+2NH3═N2H4+NaCl+H2O,
故答案为:NaClO+2NH3═N2H4+NaCl+H2O;
(2)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,HSO4-离子在阳极失电子生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,
故答案为:2HSO4--2e-═S2O82-+2H+;
(3)①在25℃前,升高温度氮去除率增大的原因是因为氨气溶解度随温度升高,溶解度减小,
故答案为:升高温度NH3的溶解度降低,有利于NH3的逸出;
②剩余的氧化镁,是难溶于水的物质沉淀出不形成污染,不会对废水形成二次污染,
故答案为:氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染;
(4)取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O];④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol•L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.依据滴定实验和反应化学方程式可知:
2NH3~(NH4)2B4O7~H2SO4
2 1
2×cV×10-3mol cV×10-3mol
水样中氮的含量=$\frac{2cV×1{0}^{-3}mol×14g/mol}{0.01L}$=2.8cV(g/L)=2800cV(mg/L),
故答案为:2800cV.
点评 本题考查了热化学方程式和盖斯定律计算应用,电极原理的分析判断电极书写,实验过程分析理解,滴定实验的计算应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
| A. | CO(g) 与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 | |
| B. |  图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol | |
| D. | CO的燃烧热为283kJ |
| A. | NH4+ Fe3+ SO42- NO3- | B. | K+ Na+ CO32- NO3- | ||
| C. | K+ NH4+ OH- SO42- | D. | Na+ K+ AlO2- Cl- |
| A. | 碳酸氢钠溶液:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COO Na 溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2 c(Na+) | |
| C. | 硫酸铜溶液与过量浓氨水反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2 NH4+ | |
| D. | 一定浓度的盐酸和氨水混合可能出现c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| A. | 烷烃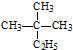 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图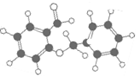 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
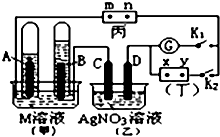 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:

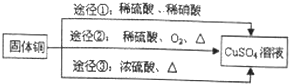
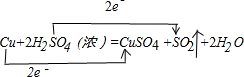 ,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.
,其中还原剂是Cu.上述途径中你认为最佳途径是②,选择的理由是原料利用率高,环境污染小.