题目内容
8.完成以下计算:(1)3.01×1023个氨分子的质量为:8.5g.
(2)标准状况下,14.9L氨气中氢原子数与98g的硫酸中氢原子数相同.
(3)2.4mol Cl2与元素R单质完全反应生成1.6mol RClx,则x值为3.
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答;
(2)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$,结合一个氨气分子中含有3个氢原子,一个硫酸分子中含有2个氢原子解答;
(3)依据氯原子个数守恒计算.
解答 解:(1)3.01×1023个氨分子物质的量为:$\frac{3.01×1{0}^{23}}{6.02×10{\;}^{23}}$=0.5mol,质量为:0.5mol×17g/mol=8.5g;
故答案为:8.5g;
(2)98g的硫酸中氢原子数为:$\frac{98g}{98g/mol}$×2×NA=2NA,设标准状况下,VL氨气中氢原子数与98g的硫酸中氢原子数相同,则:$\frac{V}{22.4L/mol}$×3×NA=2NA,
解得V=14.9;
故答案为:14.9;
(3)依据氯原子个数守恒:2.4mol Cl2含有氯原子与1.6mol RClx含有氯原子相等,即2.4mol×2=1.6mol×x,解得x=3,
故答案为:3.
点评 本题考查了物质的量相关计算,熟悉以物质的量为核心的计算公式,明确原子个数守恒规律是解题关键,题目难度不大.

练习册系列答案
相关题目
19.下列说法中正确的是( )
| A. | 化学反应中,物质变化的同时不一定发生能量变化 | |
| B. | 反应焓变(△H)的大小与方程式中各物质的化学计量系数无关 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 吸热反应中,形成化学键释放的能量大于断裂化学键吸收的能量 |
16.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
| A. | 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水 | |
| B. | 将湿润的红色石蕊试纸放入集有氨气的集气瓶中,试纸由红色变为蓝色,说明氨水呈碱性 | |
| C. | 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定 | |
| D. |  将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的直接氧化产物为NO2 |
3.我国稀土资源丰富.下列有关14462Sm与15062Sm的说法正确的是( )
| A. | 14462Sm与15062Sm 是同一种核素 | |
| B. | 14462Sm与15062Sm 互为同位素 | |
| C. | 14462Sm与15062Sm 的质量数相同 | |
| D. | 14462Sm与15062Sm 的核外电子数和中子数相同 |
13.在标准状况下,将4.48L CO2通过一定量的Na2O2固体后,收集到3.36L气体,则这3.36L气体的质量是( )
| A. | 6.0g | B. | 4.8g | C. | 3.2g | D. | 5.6g |
20.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液③硫酸铝溶液与氨水④铁与稀硝酸⑤溴化亚铁溶液与氯水⑥碳酸氢钙溶液与澄淸石灰水.
①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液③硫酸铝溶液与氨水④铁与稀硝酸⑤溴化亚铁溶液与氯水⑥碳酸氢钙溶液与澄淸石灰水.
| A. | ③⑤ | B. | ①③⑥ | C. | ②④ | D. | ②③⑥ |
2.已知室温下:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=1×10-39,pH=7.1时Mn(OH)2开始沉淀.,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol•L-1),需调节溶液pH范围为( )
| A. | 5<pH<7.1 | B. | 7.1<pH<9 | C. | 3<pH<7.1 | D. | 7.1<pH<11 |
3.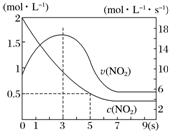 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )| A. | 5s时NO2的转化率为75% | |
| B. | 0~3 s时v(NO2)增大是由于体系温度升高 | |
| C. | 3s时化学反应处于平衡状态 | |
| D. | 9s时再充入N2O4,平衡后K较第一次平衡时大 |