题目内容
20.下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )①碳酸钠溶液与盐酸②硫化氢气体与氯化铁溶液③硫酸铝溶液与氨水④铁与稀硝酸⑤溴化亚铁溶液与氯水⑥碳酸氢钙溶液与澄淸石灰水.
| A. | ③⑤ | B. | ①③⑥ | C. | ②④ | D. | ②③⑥ |
分析 ①盐酸少量生成碳酸氢钠,盐酸足量生成二氧化碳;
②硫化氢气体与氯化铁溶液发生氧化还原反应生成氯化亚铁、S、盐酸;
③二者反应生成氢氧化铝和硫酸铵;
④Fe不足,生成硝酸铁;Fe足量生成硝酸亚铁;
⑤氯水不足只氧化亚铁离子,氯水足量氧化亚铁离子、溴离子;
⑥反应生成碳酸钙和水.
解答 解:①碳酸钠与少量盐酸:Na2CO3+HCl=NaHCO3+NaCl;与过量盐酸反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,碳酸氢根离子在离子反应中保留化学式,其离子反应不同,故不选;
②硫化氢气体与氯化铁溶液发生氧化还原反应生成氯化亚铁、S、盐酸,离子反应只有一个,故选;
③只发生Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4,离子反应只有一个,故选;
④Fe不足,生成硝酸铁;Fe足量生成硝酸亚铁,亚铁、铁离子不同,离子反应不同,故不选;
⑤氯水不足只氧化亚铁离子,氯水足量氧化亚铁离子、溴离子,离子反应不同,故不选;
⑥反应生成碳酸钙和水,离子反应均为HCO3-+Ca2++OH-=CaCO3↓+H2O,离子反应相同,故选;
故选D.
点评 本题考查离子反应的书写,为高频考点,把握与量有关的离子反应、离子反应中保留化学式的物质为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
10.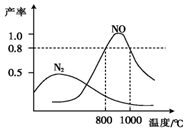 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
11.对于溶液中某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液无明显现象,再加入新制氯水溶液变为血红色,一定有Fe2+ | |
| D. | 加入过量硝酸银溶液,产生白色沉淀,再加入稀盐酸沉淀不溶解,则一定含有C1- |
15.下列实验操作中错误的是( )
| A. | 用量筒量取12.12mL的盐酸 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称量时,称量物应放在托盘天平的左盘,砝码放在托盘天平的右盘中 |
5.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.对于该反应,下列判断正确的是( )
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
12.已知反应:
①2H2(g)+O2(g)═2H2O(g)△H1
②2H2(g)+O2(g)═2H2O(l)△H2
在相同条件下:2H2O(g)═2H2O(l)的焓变为( )
①2H2(g)+O2(g)═2H2O(g)△H1
②2H2(g)+O2(g)═2H2O(l)△H2
在相同条件下:2H2O(g)═2H2O(l)的焓变为( )
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | 2△H1-2△H2 |
14.已知25℃时,电离常数Ka(HX)=3.6×10-4,溶度积常数Ksp(CaX2)=1.46×10-10.现向1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
15.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
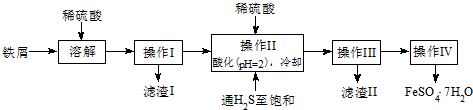
查询资料,得有关物质的数据如表:
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为A.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取一定量的绿矾产品,溶解,在250mL容量瓶中定容;b.量取一定量的待测溶液于锥形瓶中;c.再用硫酸酸化的KMnO4溶液滴定至终点.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.

查询资料,得有关物质的数据如表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取一定量的绿矾产品,溶解,在250mL容量瓶中定容;b.量取一定量的待测溶液于锥形瓶中;c.再用硫酸酸化的KMnO4溶液滴定至终点.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.