题目内容
3.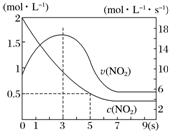 某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )
某绝热恒容容器中充入2mol•L-1 NO2,发生反应2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正确的是( )| A. | 5s时NO2的转化率为75% | |
| B. | 0~3 s时v(NO2)增大是由于体系温度升高 | |
| C. | 3s时化学反应处于平衡状态 | |
| D. | 9s时再充入N2O4,平衡后K较第一次平衡时大 |
分析 A、分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%;
B、依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大;
C、3s时二氧化氮反应速率最大,但随时间变化,速率减小,在7s后二氧化氮浓度不变是平衡状态,此时不能说明反应达到平衡状态;
D、9s时反应达到平衡状态,加入N2O4,平衡逆向进行,反应热量降低,平衡向放热分析进行,平衡常数增大
解答 解:A、分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=$\frac{消耗量}{起始量}$×100%=$\frac{1.5molL}{2mol/L}$×100%=75%,故A正确;
B、依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,随反应进行二氧化氮浓度减小,反应为达到平衡,0-3s时v(NO2)增大是由于体系温度升高,故B正确;
C、3s时二氧化氮反应速率最大,但随时间变化,速率减小,在7s后二氧化氮浓度不变是平衡状态,3s此时不处于平衡状态,故C错误;
D、9s时反应达到平衡状态,加入N2O4,平衡逆向进行,反应热量降低,平衡向放热分析进行,平衡常数增大,9s时再充入N2O4,平衡后K较第一次平衡时大,故D正确;
故选C.
点评 本题考查化学平衡的计算,题目难度中等,涉及图象分析判断,反应速率、转化率概念计算分析、平衡状态判断等知识,明确化学平衡及其影响为解答关键,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.已知25℃时,电离常数Ka(HX)=3.6×10-4,溶度积常数Ksp(CaX2)=1.46×10-10.现向1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
15.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
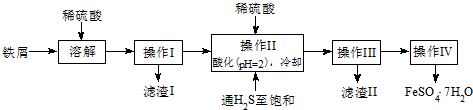
查询资料,得有关物质的数据如表:
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为A.
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取一定量的绿矾产品,溶解,在250mL容量瓶中定容;b.量取一定量的待测溶液于锥形瓶中;c.再用硫酸酸化的KMnO4溶液滴定至终点.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.

查询资料,得有关物质的数据如表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取一定量的绿矾产品,溶解,在250mL容量瓶中定容;b.量取一定量的待测溶液于锥形瓶中;c.再用硫酸酸化的KMnO4溶液滴定至终点.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
13.在强碱性的无色透明溶液中,下列离子组能大量共存的是( )
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
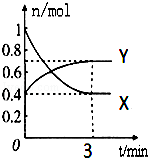 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示. 已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:
已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题: