题目内容
18.在一定条件下,密闭容器内发生可逆反应3A+m B?n C达到平衡.(1)若A、C均为气体,B为固体,则平衡常数表达式为K=$\frac{{c}^{n}(C)}{{c}^{3}(A)}$;
(2)若A、B、C均为气体,在减小压强时平衡正向移动,则3+m<n(填“>”、“<”或“=”);
(3)若该反应在任何温度下都能自发进行,则△H<0,△S>0(填“>”、“<”或“=”).
分析 (1)平衡常数等于生成物浓度幂之积比上反应物浓度幂之积;
(2)A、B、C均为气体,在减小压强时平衡正向移动,说明正反应方向是气体增大的方向;
(3)根据△G=△H-T•△S<0进行判断.
解答 解:(1)平衡常数等于生成物浓度幂之积比上反应物浓度幂之积,固体物质不代入表达式,所以K=$\frac{{c}^{n}(C)}{{c}^{3}(A)}$,故答案为:$\frac{{c}^{n}(C)}{{c}^{3}(A)}$;
(2)A、B、C均为气体,在减小压强时平衡正向移动,说明正反应方向是气体增大的方向,所以3+m<n,故答案为:<;
(3)△H<0,若能够满足△G=△H-T•△S<0,熵值增大即△S>0,在任何温度下都能自发进行,故答案为:>.
点评 本题考查平衡常数表达式、化学平衡的移动、焓变和熵变,题目难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,当△G=△H-T•△S<0,能自发进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.已知某饱和溶液中①溶质的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
从上述条件中不能用来计算该饱和溶液的物质的量浓度的是( )
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
13.2mol O2和3mol O2的质量之比( )
| A. | 2:3 | B. | 2:1 | C. | 1:1 | D. | 4:3 |
3.下列离子检验的推理正确的是( )
| A. | 向某溶液中加盐酸,有能使澄清石灰水变浑浊的气体生成,则原溶液中有CO32- | |
| B. | 向某溶液中加石蕊试液,溶液变蓝,则原溶液中溶质是碱 | |
| C. | 向某溶液中加氢氧化钠溶液,生成蓝色沉淀,则原溶液中有Cu2+ | |
| D. | 向某溶液中加氯化钡溶液,生成白色沉淀,再加盐酸沉淀不溶解,则原溶液中有SO42- |
10.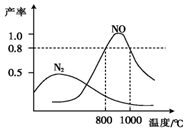 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:4NH3(g)+3O2(g)$\stackrel{催化剂}{?}$2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g)$\stackrel{催化剂}{?}$4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
7.某主族元素R的原子核外最外层上有6个电子,其最高价氧化物的化学式为( )
| A. | RO | B. | RO2 | C. | RO3 | D. | RO4 |
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+ $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+