题目内容
科学家根据自然界存在的N2制取N3,其后又陆续制取出N5、含N5+的化合物及N60.N5+极不稳定,需保存在-80℃的干冰中;N5+由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来.分析上述材料,下列说法中不正确的是( )
| A、N5+常温下会剧烈爆炸,体积急剧膨胀,放出大量的热 |
| B、N60的发现开辟了能源世界的新天地,将来可能成为很好的火箭燃料 |
| C、N2、N3、N5、N5+、N60互为同素异形体 |
| D、含N5+的化合物中既有离子键又有共价键 |
考点:同素异形体,化学键
专题:信息给予题
分析:A.根据材料信息:N5+由于其极强的爆炸性,又称为“盐粒炸弹”解答;
B.N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来据此分析解答;
C.同种元素组成性质不同的单质互为同素异形体,研究对象是单质;
D.N5+中氮原子之间以共价键结合,N5+与其他阴离子之间以离子键结合据此解答.
B.N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来据此分析解答;
C.同种元素组成性质不同的单质互为同素异形体,研究对象是单质;
D.N5+中氮原子之间以共价键结合,N5+与其他阴离子之间以离子键结合据此解答.
解答:
解:A.N5+极不稳定,N5+由于其极强的爆炸性,又称为“盐粒炸弹”,故A正确;
B.N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来,故B正确;
C.N2、N3、N5、N60互为同素异形体,N5+不是单质,故C错误;
D.N5+中氮原子之间以共价键结合,N5+与其他阴离子之间以离子键结合,故D正确.
故选C.
B.N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出来,故B正确;
C.N2、N3、N5、N60互为同素异形体,N5+不是单质,故C错误;
D.N5+中氮原子之间以共价键结合,N5+与其他阴离子之间以离子键结合,故D正确.
故选C.
点评:本题考查了同素异形体的概念和化学键类型判断,注意能够从材料中分析相关信息,结合所学的知识解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
按图1的装置进行试验,若图2中X轴表示阴极的电子的量,则Y轴可能表示为( )


| A、Cu2+物质的量浓度 |
| B、C棒的质量 |
| C、Fe棒的质量 |
| D、Cl-物质的量浓度 |
 图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )
图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )| A、电池的能量转化率可达100% |
| B、铝罐是电池的负极 |
| C、碳棒应与玩具电机的负极相连 |
| D、电池工作一段时间后碳棒和炭粒的质量会减轻 |
钛被称为21世纪金属.研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置制备金属钛.下列叙述正确的是( )


| A、乙装置阴极的电极反应式为TiO2+4e-═Ti+2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗金属铝36.0g |
| C、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D、乙装置中的石墨电极需要定期更换 |
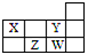 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
 A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )
A、B、C均为短周期元素,它们在周期表中的位置如图.已知B、C两元素在周期表中族序数之和是A元素族序数的2倍;B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别是( )| A、Be Na Al |
| B、B Mg Si |
| C、O P Cl |
| D、C Al P |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍,D与A为同主族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
