题目内容
如图为常温下向25mL 0.1mol?L-1 MOH溶液中逐滴滴加0.2mol?L-1HA溶液过程中溶液pH的变化曲线.回答下列问题: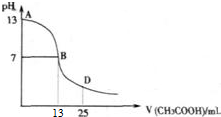
(1)如图能确定MOH为 (“强”或“弱”)碱,理由是 .
(2)如图能确定HA为 (“强”或“弱”)酸,理由是 .
(3)在D点时,溶液中c(A-)+c(HA) 2c(M+).(填“>”、“<”或“=”)

(1)如图能确定MOH为
(2)如图能确定HA为
(3)在D点时,溶液中c(A-)+c(HA)
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)0.1mol?L-1 MOH溶液的pH=13可知,MOH为强碱;
(2)根据当加入13mlHA溶液时pH=7来判断;
(3)在D点时,溶液中的溶质是物质的量浓度相同的MA盐和HA酸的混合溶液,据此分析.
(2)根据当加入13mlHA溶液时pH=7来判断;
(3)在D点时,溶液中的溶质是物质的量浓度相同的MA盐和HA酸的混合溶液,据此分析.
解答:
解:(1)由图可知,0.1mol?L-1 MOH溶液的pH=13,即C(OH-)=
=
=0.1mol/L,说明MOH完全电离,故为强碱,
故答案为:强;0.1mol?L-1 MOH溶液的pH=13,说明MOH完全电离,所以MOH是强碱;
(2)当加入13mlHA溶液时,n(HA)>n(MOH),此时溶液中的溶质是MA盐和过量的HA酸,而此时pH=7,说明MA呈碱性,即为强碱弱酸盐,故说明HA为弱酸,
故答案为:弱;当加入13mlHA溶液时,酸稍过量,而此时pH=7,说明MA呈碱性,即为强碱弱酸盐,说明HA为弱酸;
(3)在D点时,溶液中的溶质是物质的量浓度相同的MA盐和HA酸的混合溶液,根据物料守恒可知,c(A-)+c(HA)=2c(M+),故答案为:=.
| Kw |
| C(H+) |
| 10-14 |
| 10-13 |
故答案为:强;0.1mol?L-1 MOH溶液的pH=13,说明MOH完全电离,所以MOH是强碱;
(2)当加入13mlHA溶液时,n(HA)>n(MOH),此时溶液中的溶质是MA盐和过量的HA酸,而此时pH=7,说明MA呈碱性,即为强碱弱酸盐,故说明HA为弱酸,
故答案为:弱;当加入13mlHA溶液时,酸稍过量,而此时pH=7,说明MA呈碱性,即为强碱弱酸盐,说明HA为弱酸;
(3)在D点时,溶液中的溶质是物质的量浓度相同的MA盐和HA酸的混合溶液,根据物料守恒可知,c(A-)+c(HA)=2c(M+),故答案为:=.
点评:本题考查了酸碱性的强弱判断和离子浓度之间的关系,分析出反应后的溶液中的溶质是解题的关键,难度不大.

练习册系列答案
相关题目
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
| A、次磷酸的电离方程式为H3PO2?3H++PO23- |
| B、次磷酸中P的化合价为+1 |
| C、NaH2PO2是酸式盐 |
| D、NaH2PO2溶液显弱酸性 |
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出:
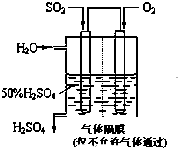 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知: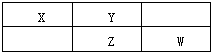 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示: