题目内容
3.乙二酸(HOOC-COOH)俗称草酸.草酸晶体的化学式为H2C2O4•2H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解产生CO、CO2和H2O,单酸蒸气在低温下可冷凝为固体;草酸是一种二元弱酸但酸性比碳酸强,具有还原性能使酸性高锰酸钾溶液褪色,草酸钙难溶于水,回答下列问题:(1)写出草酸晶体受热分解的化学方程式H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O.
(2)可用下列装罝验证草酸晶体的分解产物(草酸晶体分解装置、夹待装置及连接导管均略去).
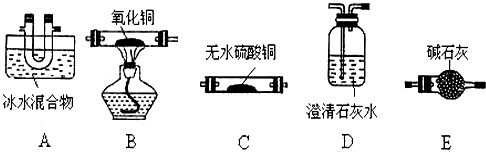
①装置的连接顺序为:A、CDEDEB、D
②A装置的作用是除去混合气体中的草酸蒸气,检验产物中有CO的实验现象是B中的固体由黑色变为紫红色,B后D装置中的澄清石灰水变浑浊.
③写出整套装置存在不合理之处无CO的尾气处理装置.
(3)下列叙述能说明草酸具有弱酸性的是bd.
a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
b.测定草酸钠(Na2C2O4)溶液的pH
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸消牦碱的能力强
d.pH=2的草酸溶液和稀硫酸,分别稀释100倍后前者pH小
e.将草酸晶体加入Na2CO3溶液中,有CO2放出
(4)已知:NH3•H2O?NH4++OH-,Kb=1.85×10-5
H2C2O4?H++HC2O4-Ka1=5.4×10-2
HC2O4-?H++C2O42-Ka2=5.4×10-5
则(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
(5)可用0.10mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液.
①确定过程中发生反成的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
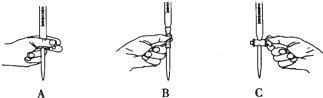
②滴定过程中操作滴定管的图示正确的是A.
③每次准确量取25.00mL草酸溶液,滴定三次分别消耗0.10mol/L酸性KMnO4标准溶液的体积是20.00mL、
19.80mL、20.20mL,则该草酸溶液的物质的量浓度为0.20mol/L.
分析 (1)草酸分解产生CO、CO2和H2O,反应方程式为H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O;
(2)①猜想其产物为CO、CO2和H2O,草酸在100℃时开始升华,157℃时大量升华,并开始分解.草酸钙不溶于水、草酸蒸气能使澄清石灰水变浑浊、草酸蒸气在低温下可冷凝为固体,分析可知先冷凝挥发出的草酸,再检验水蒸气的生成,检验二氧化碳的生成,并除去二氧化碳,再通过灼热的氧化铜检验一氧化碳气体的存在,利用反应后生成的二氧化碳通入澄清石灰水变浑浊证明一氧化碳的存在;
②草酸蒸气能使澄清石灰水变浑浊,A装置的作用是除去混合气体中的草酸蒸气,检查CO的现象为B中黑色氧化铜变红色,B后D装置中的澄清石灰水变浑浊;
③一氧化碳有毒,会污染空气,需要吸收处理装置;
(3)证明草酸具有弱酸性,需要证明草酸在溶液中部分电离,存在电离平衡;
(4)由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;
(5)①高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开;
③滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,消耗的KMnO4溶液的体积平均为是$\frac{20.00mL+19.80mL+20.20mL}{3}$=20mL,
n(高锰酸钾)=0.10mol/L×0.02L=0.002mol,则根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算c.
解答 解:(1)草酸分解产生CO、CO2和H2O,反应方程式为H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O,
故答案为:H2C2O4•2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O;
(2)①分解产物为CO、CO2和H2O,检验时应该先用无水硫酸铜检验水蒸气,然后用澄清石灰水检验二氧化碳,最后用加热的CuO和澄清石灰水检验CO,所以仪器的连接顺序为:A→C→D→E→B→D,
故答案为:A C B D;
②草酸蒸气能使澄清石灰水变浑浊,A装置的作用是除去混合气体中的草酸蒸气,当装置B中黑色固体变成红色,且装置D澄清石灰水变浑浊,则证明混合气体中含有CO,
故答案为:除去混合气体中的草酸蒸气;B中的固体由黑色变为紫红色,B后D装置中的澄清石灰水变浑浊;
③一氧化碳有毒污染空气,需要吸收处理装置,一氧化碳尾气的处理方法为点燃,操作时将气体通到酒精灯火焰上燃烧,
故答案为:无CO的尾气处理装置;
(3)a.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色,只能说明酸碱反应,不能说明草酸是弱酸,故a错误;
b.测定草酸钠(Na2C2O4)溶液的pH,若显碱性,证明草酸根离子水解,证明草酸是弱酸,故b正确;
c.等体积等浓度的草酸溶液和稀硫酸,稀硫酸为二元强酸,消牦碱的能力比草酸强,但不能说明草酸为弱酸,故c错误;
d.草酸和硫酸都是二元酸,测定相同浓度的草酸和硫酸溶液的pH,若不同PH大的为草酸证明存在电离平衡,故d正确;
e.将草酸溶液加入Na2CO3溶液中,有CO2放出,只能说明草酸酸性大于碳酸,但不能证明草酸是弱酸,故e错误;
故答案为:bd;
(4)由表格可知,K1>K,根据越弱越水解,(NH4)2C2O4中NH4+更弱,水解显酸性,pH<7;
故答案为:<;
(5)①高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
②根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作;
故答案为:A;
③滴定三次分别消耗的KMnO4溶液的体积是20.00mL、19.80mL、20.20mL,消耗的KMnO4溶液的体积平均为是$\frac{20.00mL+19.80mL+20.20mL}{3}$=20mL,
n(高锰酸钾)=0.10mol/L×0.02L=0.002mol,则:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
2mol 5mol
0.002mol c×0.025L
解得c=0.20mol/L,
故答案为:0.20mol/L.
点评 本题考查了性质实验方案设计的方法,涉及化学实验、氧化还原反应、离子反应及化学计算相关知识,题目难度较大,注意掌握探究物质性质实验方案设计的方法,明确物质性质及实验操作方法为解答关键,试题有利于提高学生的分析、理解能力及化学实验能力.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案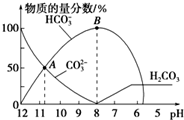 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
| A. | 该 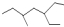 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 棉花、羊毛、合成纤维、油脂的成分都是高分子化合物 | |
| C. | 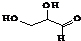 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相等 |
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |

(1)图1中铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
(2)图1中NaOH溶液能够吸收的有害气体是二氧化氮和一氧化氮气体.
(3)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的A(填序号).
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同.故得出结论:Cu2+并不是反应的催化剂.
Ⅲ.丙同学根据现象推测反应过程中还有少量NO2生成,进而认为该物质对反应有催化作用,如图2所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管.小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用.
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色.部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质.丁同学设计了一个实验方案证明后者的推测更为合理.(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
| A. | -824.4kJ•mol-1 | B. | -627.6kJ•mol-1 | C. | -744.7kJ•mol-1 | D. | -169.4kJ•mol-1 |
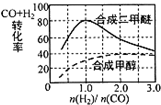 碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应:
碳和碳的化合物在生产、生活中有重要作用,甲醇水蒸气重整制氢系统可能发生下列三个反应: