题目内容
18.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O→4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
分析 A.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由-1价变为0价和-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物;
B.该反应中有4mol过氧化钠反应时有3mol过氧化钠得电子发生还原反应,只有过氧化钠作氧化剂;
C.根据转移电子相等计算;
D.该反应中生成的就是红褐色沉淀.
解答 解:A.该反应中Fe元素化合价由+2价变为+3价、O元素化合价由-1价变为0价和-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,所以Fe2+和$\frac{1}{4}$的过氧化钠作还原剂,Fe(OH)3是还原产物,故A错误;
B.该反应中有4mol过氧化钠反应时有3mol过氧化钠得电子发生还原反应,有$\frac{3}{4}$的过氧化钠作氧化剂,则4 mol Na2O2在反应中共得到6NA个电子,故B错误;
C.根据转移电子相等得被Fe2+还原的氧化剂的物质的量=$\frac{0.2mol×2}{1}$=0.4mol,故C正确;
D.该反应中有氧气生成,所以不能先生成氢氧化亚铁沉淀,而是直接生成红褐色沉淀,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,明确氧化还原反应基本概念、各个物理量之间的有关计算等知识点是解本题关键,注意过氧化钠部分做氧化剂、部分做还原剂,为易错点.

练习册系列答案
相关题目
5.为测定空气中CO2含量,做下述实验:
(1)为配置标准溶液,请选取必需的一组仪器B;
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)①本实验中,用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液时,由于操作不当,滴定结束后滴定管尖嘴处有一气泡,则实际用去盐酸大于19.60mL(填大于、小于、等于)
②若滴定Ba(OH)2溶液时使用的酸式滴定管未经处理,即换0.01mol•L-1盐酸溶液进行第二次滴定,导致算出空气中CO2值(填偏高、偏低或无影响)偏低.
(5)由实验数据算出空气中CO2的体积分数为0.025%.
| 配0.1mol/L的标准盐酸和0.01mol•L-1的标准盐酸 | → | 用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液10mL用去盐酸19.60mL | → | 用Ba(OH)2溶液吸收10L空气中的CO2(标准状况) | → | 过 滤 | → | 取滤液20mL,用0.01mol•L-1的盐酸滴定用去盐酸34.8mL |
①托盘天平 ②容量瓶 ③滴定管 ④量筒 ⑤烧杯 ⑥胶头滴管 ⑦玻璃棒
A、①②⑤⑥B、②④⑤⑥⑦C、①②⑥⑦D、②④⑤⑥
(2)滴定操作时,左手控制酸式滴定管活塞,眼睛注视液滴下滴速度和锥形瓶中溶液颜色的变化;
(3)取上述Ba(OH)2溶液10mL放入100mL容量瓶中,加水稀释至刻度,把稀释后的溶液放入密闭容器,并引入10L空气,振荡,过滤.需过滤的原因是除去BaCO3沉淀,使滤液只含Ba(OH)2,以保证实验成功;
(4)①本实验中,用0.1mol•L-1的标准盐酸滴定未知Ba(OH)2溶液时,由于操作不当,滴定结束后滴定管尖嘴处有一气泡,则实际用去盐酸大于19.60mL(填大于、小于、等于)
②若滴定Ba(OH)2溶液时使用的酸式滴定管未经处理,即换0.01mol•L-1盐酸溶液进行第二次滴定,导致算出空气中CO2值(填偏高、偏低或无影响)偏低.
(5)由实验数据算出空气中CO2的体积分数为0.025%.
9.我国新修订的《环境保护法》已于2015年1月1日起施行.下列有关做法不正确的是( )
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
6.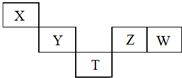 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
 X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )
X~T元素在周期表中的相对位置如图所示,其中X、Y、Z、W元素原子的最外层电子数之和为20,T为第4周期元素.下列说法正确的是( )| A. | YW4与H2在高温下反应主要生成YH4和HW | |
| B. | X的原子半径比T原子半径小,两者原子序数之差为29 | |
| C. | W氧化物的水化物的酸性一定强于Z的氧化物的水化物 | |
| D. | T的氢化物可能具有强的还原性,其稳定性小于Z的氢化物 |
13.常温下,800ml pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、NO2-、I-、SO42-中的四种,且各离子的物质的量浓度均为0.1mol•L-1,现取该溶液进行有关实验,已知HNO2是一种不稳定的弱酸,实验结果如图所示:
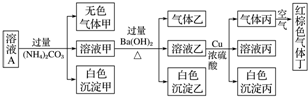
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 该溶液中一定有NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验最多消耗Cu 1.92g,生成气体丙在标准状态下体积为448mL | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 为确定原溶液中是否有Na+、K+,可通过焰色反应来确定 |
8.下列分子中的各原子均在同一平面上的是( )
| A. | C2H3Cl | B. | CHCl3 | C. | CH3CH═CH2 | D. | CH3-CH3 |
 对物质性质的认识源于对其结构的了解.
对物质性质的认识源于对其结构的了解. .
.