题目内容
8.某兴趣小组在利用图1所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深.该小组同学拟通过实验探究反应速率变化的原因.
(1)图1中铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O.
(2)图1中NaOH溶液能够吸收的有害气体是二氧化氮和一氧化氮气体.
(3)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的A(填序号).
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同.故得出结论:Cu2+并不是反应的催化剂.
Ⅲ.丙同学根据现象推测反应过程中还有少量NO2生成,进而认为该物质对反应有催化作用,如图2所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管.小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用.
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色.部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质.丁同学设计了一个实验方案证明后者的推测更为合理.(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
| 向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体) | 溶液颜色变蓝(或绿色加深) |
分析 (1)铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
(2)NaOH溶液可以吸收二氧化氮和一氧化氮气体;
(3)Ⅰ.测量温度变化的常用仪器为温度计;验证温度对速率的影响,获得实验数据后可以获得一系列结论,如果把它放在整个实验探究中去理解可知最重要的结论是反应液温度上升不是反应速率明显加快的主要原因;
Ⅱ.加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子;
Ⅲ.液面上方的气体颜色不断加深,说明生成了NO2气体;
(4)根据改变溶解气体的浓度是否影响溶液的颜色来判断.
解答 解:(1)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO?+4H2O,
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O;
(2)NaOH溶液可以吸收二氧化氮和一氧化氮气体,反应的离子方程式为:NO+NO2+2OH-═2NO2-+H2O,
故答案为:二氧化氮和一氧化氮气体;
(3)Ⅰ.由表中数据可知,随着反应的进行,反应速率明显加快,但温度变化不大,所以温度不是反应速率明显加快的主要原因,
故答案为:温度不是反应速率明显加快的主要原因;
Ⅱ.加入固体,不能加入溶液,否则溶液浓度减小,不能加入硫酸根离子,
故答案为:A;
Ⅲ.液面上方的气体颜色不断加深,说明生成了NO2气体,
故答案为:NO2;
(4)要证明是溶解了NO2导致装置中溶液呈绿色,可设计将溶解的NO2赶走再观察颜色变化,
故答案为:向该绿色溶液中通入氮气(或向硝酸铜溶液中通入浓硝酸与铜反应产生的气体);溶液颜色变蓝(或绿色加深).
点评 本题考查了铜和硝酸的反应实验,难点是(4)题,会设计实验验证是溶解了NO2导致装置中溶液呈绿色,设计实验是高考的热点,也是学习的难点.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案| A. | 二 | B. | 一 | C. | 四 | D. | 三 |
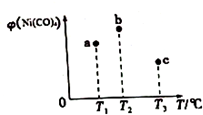 在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )
在容积均为1L的三个密闭容器中,分别放入镍粉并充入1molCO,控制作在不同温度下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),当反应进行到5min时,测得Ni(CO)4的体积分数与温度的关系如图所示.下列说法正确的是( )| A. | 正反应为吸热反应,平衡常数:K(T1)>K(T2) | |
| B. | 反应进行到5min时,b容器中v(正)=v(逆) | |
| C. | 达到平衡时,a、b、c中CO的转化率为b>a>c | |
| D. | 减压或升温可将b中的平衡状态转变成c中的平衡状态 |
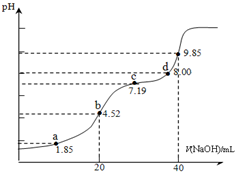 已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)>3c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)═2PbO(s)+2SO2(g)△H=a kJ•mol-1
②PbS(s)+2PbO(s)═3Pb(s)+SO2(g)△H=b kJ•mol-1
③PbS(s)+PbSO4(s)═2Pb(s)+2SO2(g)△H=c kJ•mol-1
反应3PbS(s)+6O2(g)═3PbSO4(s)△H=2a+2b-3ckJ•mol-1(用含a、b、c的代数式表示)
(2)还原法炼铅,包含反应PbO(s)+CO(g)?Pb(s)+CO2(g)△H,该反应的平衡常数的对数值与温度的关系如下表.
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为9.09%.
(3)引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如图甲所示,该电池正极的电极反应式为PbSO4+2e-═SO42-+Pb(或PbSO4+Ca2++2e-═CaSO4+Pb).
(4)PbI2可用于人工降雨.取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-,用250mL洁净的锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图乙),加入酚酞指示剂,用0.002 5mol•L-1 NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.可计算出t℃时 PbI2的Ksp为4×10-9.
(5)铅易造成环境污染.水溶液中铅的存在形态主要有6种,它们与pH关系如图丙所示.含铅废水用活性炭进行处理,铅的去除率与pH关系如图丁所示.
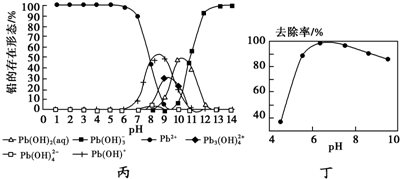
①常温下,pH=6~7时,铅形态间转化的离子方程式为Pb2++H2O?Pb(OH)++H+.
②用活性炭处理,铅的去除率较高时,铅主要应该处于Pb2+形态.(填化学式)
 .
.