题目内容
在高温、高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 .(填字母)
A.容器内的压强保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与H2的生成速率相等
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g);反应达到平衡时,CO的转化率大于70%,则 CH3OH的物质的量浓度可能为 .
A.0.9mol/L B.1.0mol/L C.1.5mol/L D.0.5mol/L
若经过3分钟,CH3OH达到了以上浓度,则v(CO)= ,该反应的化学平衡常数表达式为:K= .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知部分键能数据如下:
则该反应的△H= (用含a、b、c、d的式子表示).
(4)利用NH3和CH4等气体除去烟气中的氮氧化物.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ?mol-1; 欲计算反应CH4(g)+4NO(g)═CO2(g)+2H2O(l)+2N2(g)的焓变△H2 则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=b kJ?mol-1,该反应的热化学方程式是 . 据此计算出△H2= kJ?mol-1 (用含a、b的式子表示).
(5)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)?HCOOCH3(g)
△H=-29.1kJ?mol-1.科研人员对该反应进行了研究.部分研究结果如下:
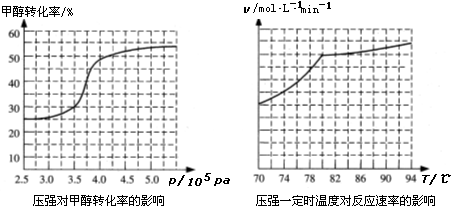
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强范围是 .
②实际工业生产中采用的温度是80℃,其理由是 .
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有
A.容器内的压强保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.CO的生成速率与H2的生成速率相等
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g);反应达到平衡时,CO的转化率大于70%,则 CH3OH的物质的量浓度可能为
A.0.9mol/L B.1.0mol/L C.1.5mol/L D.0.5mol/L
若经过3分钟,CH3OH达到了以上浓度,则v(CO)=
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)?CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是
②已知部分键能数据如下:
| 化学健 | C≡O | H-H | C-H | H-O |
| 键能(kJ/mol) | a | b | c | d |
(4)利用NH3和CH4等气体除去烟气中的氮氧化物.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ?mol-1; 欲计算反应CH4(g)+4NO(g)═CO2(g)+2H2O(l)+2N2(g)的焓变△H2 则还需要查询某反应的焓变△H3,当反应中各物质的化学计量数之比为最简整数比时,△H3=b kJ?mol-1,该反应的热化学方程式是
(5)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g)?HCOOCH3(g)
△H=-29.1kJ?mol-1.科研人员对该反应进行了研究.部分研究结果如下:

①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强范围是
②实际工业生产中采用的温度是80℃,其理由是
考点:化学平衡的计算,热化学方程式,焓变和熵变,化学平衡的影响因素,化学平衡状态的判断,化学反应速率变化曲线及其应用,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:(1)恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),平衡标志是正逆反应速率相同,各组分含量不变;
(2)CO的转化率大于70%,结合平衡三段式列式计算,依据反应速率和平衡常数概念计算和书写;
(3)①依据自发进行的判断依据分析,△H-T△S<0;
②反应焓变=反应物键能之和-生成物键能之和得到;
(4)根据化学方程式和盖斯定律来解答本题;
(5)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
(2)CO的转化率大于70%,结合平衡三段式列式计算,依据反应速率和平衡常数概念计算和书写;
(3)①依据自发进行的判断依据分析,△H-T△S<0;
②反应焓变=反应物键能之和-生成物键能之和得到;
(4)根据化学方程式和盖斯定律来解答本题;
(5)①依据转化率曲线分析判断;
②图象分析速率随温度变化的趋势分析回答.
解答:
解:(1)在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g),
A、反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故A确;
B、容器中H2浓度与CO浓度相等不一定达到平衡,故B误;
C、反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故C确;
D、O的生成速率与H2的生成速率相等,证明反应正向进行,故D错误;
故答案为:AC;
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g);反应达到平衡时,CO的转化率大于70%,
CO(g)+2H2(g)?CH3OH(g);
起始量(mol) 2 6 0
变化量(mol) 1.4 2.8 1.4
平衡量(mol) 0.6 3.2 1.4
甲醇的浓度为=
=0.7mol/L,CO的转化率大于70%,则甲醇浓度大于0.7mol/L,极值转化甲醇物质的量为2mol,浓度为1mol/L,反应是可逆反应,不能进行彻底,甲醇浓度小于1mol/L,所以甲醇浓度在1mol/L~0.7 mol/L,选A;
若经过3分钟,CH3OH达到了以上浓度,则v(CO)=
=0.3mol/L,该反应的化学平衡常数表达式为:K=
;
故答案为:A;0.3mol/L;
;
(3)①CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
②CO(g)+3H2(g)?CH4(g)+H2O(g),反应焓变=反应物键能之和-生成物键能之和,反应焓变△H=(a+3b-4c-2d)KJ/mol;
故答案为:-(4c+2d-a-3b)kJ.mol-1或(a+3b-4c-2d)kJ.mol-1;
(4)由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ/mol①
CH4(g)+4NO(g)═CO2(g)+2H2O(l)+2N2(g)△H2 ②
可知反应③的热化学方程式为:O2(g)+N2(g)=2NO(g)△H3=bkJ/mol
故反应②的△H2=(a-2b)kJ/mol
故答案为:O2(g)+N2(g)=2NO(g)△H3=bkJ/mol;a-2b;
(5)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
故答案为:3.5×106 Pa~4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
A、反应前后气体压强变化的反应,容器内的压强保持不变,说明反应达到平衡,故A确;
B、容器中H2浓度与CO浓度相等不一定达到平衡,故B误;
C、反应中有固体碳反应,平衡变化,气体质量发生变化,容器中混合气体的密度保持不变,能说明反应达到平衡,故C确;
D、O的生成速率与H2的生成速率相等,证明反应正向进行,故D错误;
故答案为:AC;
(2)在一容积为2L的密闭容器内加入2mol的CO和6mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g)?CH3OH(g);反应达到平衡时,CO的转化率大于70%,
CO(g)+2H2(g)?CH3OH(g);
起始量(mol) 2 6 0
变化量(mol) 1.4 2.8 1.4
平衡量(mol) 0.6 3.2 1.4
甲醇的浓度为=
| 1.4mol |
| 2L |
若经过3分钟,CH3OH达到了以上浓度,则v(CO)=
| 0.9mol/L |
| 3min |
| c(CH3OH) |
| c(CO)c2(H2) |
故答案为:A;0.3mol/L;
| c(CH3OH) |
| c(CO)c2(H2) |
(3)①CO(g)+3H2(g)?CH4(g)+H2O(g),反应△S<0,依据自发进行的判断依据△H-T△S<0,所以△H<0,故答案为:该反应△H<0;
②CO(g)+3H2(g)?CH4(g)+H2O(g),反应焓变=反应物键能之和-生成物键能之和,反应焓变△H=(a+3b-4c-2d)KJ/mol;
故答案为:-(4c+2d-a-3b)kJ.mol-1或(a+3b-4c-2d)kJ.mol-1;
(4)由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=a kJ/mol①
CH4(g)+4NO(g)═CO2(g)+2H2O(l)+2N2(g)△H2 ②
可知反应③的热化学方程式为:O2(g)+N2(g)=2NO(g)△H3=bkJ/mol
故反应②的△H2=(a-2b)kJ/mol
故答案为:O2(g)+N2(g)=2NO(g)△H3=bkJ/mol;a-2b;
(5)①从反应压强对甲醇转化率的影响“效率“看,图象中转化率变化最大的是3.5×106 Pa~4.0×106Pa,
故答案为:3.5×106 Pa~4.0×106Pa;
②依据图象分析温度在高于80°C对反应速率影响不大,反应是放热反应,温度过高,平衡逆向进行,不利于转化率增大,
故答案为:高于80℃时,温度对反应速率影响较小;且反应放热,升高温度时平衡逆向移动,转化率降低.
点评:本题考查平衡标志的判断,热化学方程式的计算应用,图象分析判断,注意掌握基础知识的掌握,题目难度中等.

练习册系列答案
相关题目
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含2.24g铁粉的脱氧剂,理论上最多能吸收氧气672mL(标准状况) |
| C、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4 e-=4OH- |
| D、脱氧过程中铁作原电池正极,电极反应为:Fe-2e-=Fe2+ |
 利用如图所示装置制取氧气并进行相关的实验探究.
利用如图所示装置制取氧气并进行相关的实验探究.