题目内容
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H═-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
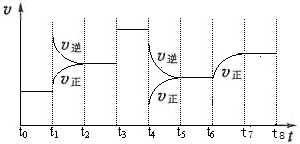
试回答下列问题:
(1)T℃时,N2的转化率为: ,该反应的平衡常数K= .
(2)T℃时,下列能证明该反应已经建立平衡状态的是: .
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是 ,平衡常数K(t5~t6) K(t7~t8)(填“>、<或=”,下同).
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正 v逆.

试回答下列问题:
(1)T℃时,N2的转化率为:
(2)T℃时,下列能证明该反应已经建立平衡状态的是:
A.体系总压强不再改变
B.混合气体颜色不再改变
C.H2的质量百分含量不再改变
D.c(N2)与c(NH3)的比值不再改变
(3)t1时刻,改变的外界条件是
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正
考点:化学反应速率变化曲线及其应用,化学平衡状态的判断,化学平衡的计算
专题:化学平衡专题
分析:(1)转化率为已转化的反应物浓度与起始浓度的百分比;化学平衡常数为平衡时生成物浓度系数次幂与反应物浓度系数次幂乘积的比值;
(2)根据化学平衡状态特征判断;
(3)根据t1时刻,正逆反应速率变化判断;温度相同,化学平衡常数相同;
(4)根据浓度商和化学平衡常数比较,判断化学平衡移动方向.
(2)根据化学平衡状态特征判断;
(3)根据t1时刻,正逆反应速率变化判断;温度相同,化学平衡常数相同;
(4)根据浓度商和化学平衡常数比较,判断化学平衡移动方向.
解答:
解:(1)某容积恒为2L密闭容器中充入2molN2、4molH2,则二者起始浓度分别为1mol/L、2mol/L,由于生成NH3的量为2mol,平衡时浓度为1mol/L,即N2和lH2转化的浓度分别为:1mol/L×
=0.5mol/L、1mol/L×
=1.5mol/L,平衡时浓度分别为:1mol/L-0.5mol/L=0.5mol/L、2mol/L-1.5mol/L=0.5mol/L,则N2的转化率为:
×100%=50%;化学平衡常数为:
=16,
故答案为:50%;16;
(2)A.反应前后气体体积不同,即化学平衡移动时,气体压强发生变化,当压强不变时,化学平衡不再移动,达到化学平衡状态,故A正确;
B.该反应中气体均无色,不论是否达到化学平衡状态,颜色均不变,故B错误;
C.H2的质量百分含量不再改变,化学平衡不再移动,达到化学平衡状态,故C正确;
D.c(N2)与c(NH3)的比值,随化学平衡移动而变化,比值不变时,达到化学平衡状态,故D正确;
故选ACD;
(3))t1时刻到)t2时刻,化学平衡向逆反应方向移动,且正逆反应速率均增大,不难判断改变的条件为升高温度;t5~t6,平衡不发生移动,则温度不变,则化学平衡常数不变,故答案为:升温;=
(4)T℃时,向容器中加入2molN2和2molNH3,则N2和NH3浓度分别为:0.5mol/L+
=1.5mol/L、1mol/L+
=2mol/L,浓度商为:
=21.3>16,化学平衡向逆反应方向移动,故v正<v逆,故答案为:<.
| 1 |
| 2 |
| 3 |
| 2 |
| 0.5mol/L |
| 1mol/L |
| (1mol/L)2 |
| (0.5mol/L)?(0.5mol/L)3 |
故答案为:50%;16;
(2)A.反应前后气体体积不同,即化学平衡移动时,气体压强发生变化,当压强不变时,化学平衡不再移动,达到化学平衡状态,故A正确;
B.该反应中气体均无色,不论是否达到化学平衡状态,颜色均不变,故B错误;
C.H2的质量百分含量不再改变,化学平衡不再移动,达到化学平衡状态,故C正确;
D.c(N2)与c(NH3)的比值,随化学平衡移动而变化,比值不变时,达到化学平衡状态,故D正确;
故选ACD;
(3))t1时刻到)t2时刻,化学平衡向逆反应方向移动,且正逆反应速率均增大,不难判断改变的条件为升高温度;t5~t6,平衡不发生移动,则温度不变,则化学平衡常数不变,故答案为:升温;=
(4)T℃时,向容器中加入2molN2和2molNH3,则N2和NH3浓度分别为:0.5mol/L+
| 2mol |
| 2L |
| 2mol |
| 2L |
| (2mol/L)2 |
| 1.5mol/L?(0.5mol/L)3 |
点评:本题考查化学平衡状态判断、化学平衡移动、平衡转化率和化学平衡常数,难度不大,能够熟练掌握化学平衡常数的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
有机物分子中含有40个电子,它燃烧时生成等体积的CO2和H2O,该有机物的分子式为( )
| A、C4H8 |
| B、C4H10O |
| C、C5H10 |
| D、C4H10 |
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: