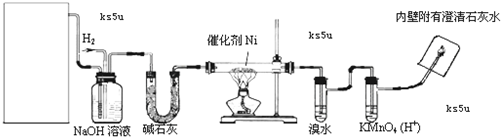
题目内容
在长期的航天飞行中,比较难解决的问题是宇航员的食物与氧气供应问题.科学家发现,在太空舱内“饲养”小球藻可以很好地解决这个问题,因为1kg小球藻(鲜重)经光合作用每小时约可释放氧气224mL(标准状况).一名宇航员要维持正常的生命活动,每小时约需0.25mol的葡萄糖提供能量.请回答下列有关问题:
(1)1kg小球藻在光照条件下,每小时可产生 g葡萄糖.
(2)若一名宇航员维持生命活动所需的葡萄糖全部来自小球藻的光合作用,则太空舱内至少应“饲养”小球藻 kg.
(3)若宇航员每天(24小时)消耗的900g葡萄糖全部由小球藻提供(不考虑小球藻的自身消耗),则“饲养”的这些小球藻至少需光照 h.
(4)若宇航员用18O标记的水来培植小球藻,则经过一段时间后,首先出现含18O的应是 (填写下列选项的字母),理由是 .
A.小球藻的光合产物C6H12O6
B.小球藻的呼吸产物二氧化碳
C.宇航员的呼吸产物二氧化碳
D.宇航员的尿液.
(1)1kg小球藻在光照条件下,每小时可产生
(2)若一名宇航员维持生命活动所需的葡萄糖全部来自小球藻的光合作用,则太空舱内至少应“饲养”小球藻
(3)若宇航员每天(24小时)消耗的900g葡萄糖全部由小球藻提供(不考虑小球藻的自身消耗),则“饲养”的这些小球藻至少需光照
(4)若宇航员用18O标记的水来培植小球藻,则经过一段时间后,首先出现含18O的应是
A.小球藻的光合产物C6H12O6
B.小球藻的呼吸产物二氧化碳
C.宇航员的呼吸产物二氧化碳
D.宇航员的尿液.
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算氧气的物质的量,通过化学方程式得到葡萄糖的物质的量,带入m=n?M计算质量;
(2)根据一名宇航员每小时所需葡萄糖的质量与每千克小球藻产生的葡萄糖相比较,即可得到所需的小球藻的质量;
(3)有题干可计算出每小时1 kg小球藻可产生0.3 g葡萄糖,则可以计算出要产生900 g葡萄糖,需150 g小球藻的光照时间;
(4)用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外.
| V |
| Vm |
(2)根据一名宇航员每小时所需葡萄糖的质量与每千克小球藻产生的葡萄糖相比较,即可得到所需的小球藻的质量;
(3)有题干可计算出每小时1 kg小球藻可产生0.3 g葡萄糖,则可以计算出要产生900 g葡萄糖,需150 g小球藻的光照时间;
(4)用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外.
解答:
解:(1)标准状况下224ml氧气的物质的量为:
=0.01mol,小球藻在光照条件下发生如下反应:6CO2+6H2O→C6H12O6+6 O2,生成葡萄糖的物质的量为
×0.01mol=0.00167mol,其质量为0.00167mol×180g/mol=0.3g,
故答案为:0.3;
(2)根据一名宇航员每小时所需葡萄糖的质量与每千克小球藻产生的葡萄糖相比较,即可得到所需的小球藻的质量为0.25 mol×
=150 kg.
(3)若宇航员每天(24小时)消耗的900g葡萄糖全部由小球藻提供,则每小时1 kg小球藻可产生0.3 g葡萄糖,则要产生900 g葡萄糖,需150 g小球藻至少光照
=20小时.
故答案为:20;
(4)用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外,因此首先出现含18O的应是宇航员的尿液,
故答案为:D;用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外.
| 0.224L |
| 22.4L/mol |
| 1 |
| 6 |
故答案为:0.3;
(2)根据一名宇航员每小时所需葡萄糖的质量与每千克小球藻产生的葡萄糖相比较,即可得到所需的小球藻的质量为0.25 mol×
| 180g/mol |
| 0.3g/kg |
(3)若宇航员每天(24小时)消耗的900g葡萄糖全部由小球藻提供,则每小时1 kg小球藻可产生0.3 g葡萄糖,则要产生900 g葡萄糖,需150 g小球藻至少光照
| 900 |
| 150×0.3 |
故答案为:20;
(4)用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外,因此首先出现含18O的应是宇航员的尿液,
故答案为:D;用18O标记的水被小球藻分解产生O2,O2被宇航员吸收参加有氧呼吸产生水,部分水随尿液排出体外.
点评:本题是一道化学和生物的综合性题目,难度不大,侧重于根据化学方程式的计算能力、新知识接受及应用能力的考查.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
下列说法中正确的是( )
| A、蔗糖和麦芽糖互为同分异构体 |
| B、乙酸乙酯和食用植物油均可水解生成乙醇 |
C、用甘氨酸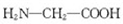 和丙氨酸 和丙氨酸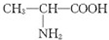 缩合最多可形成3种二肽 缩合最多可形成3种二肽 |
| D、合成聚乙烯塑料、酚醛塑料和聚苯乙烯塑料所发生的反应类型相同 |
下列说法正确的是( )
| A、在标准状况下,1摩尔任何物质的体积都约为22.4升 |
| B、22.4升氧气所含的氧原子数为2 NA个 |
| C、在标准状况下,1摩尔水的体积约为22.4升 |
| D、1摩尔某气体的体积约为22.4升时,该气体不一定处于标准状况下 |