题目内容
6.部分中学化学常见元素的原子结构和性质如下表所示:| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式
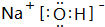 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.
分析 单质A为相同条件下密度最小的气体,则A为H元素;B基态原子最外层电子排布式为nsnnpn,s能级容纳2个电子,则n=2,故B为碳元素;E的单质为双原子分子,在标准状况下密度为1.4285g/L,则其摩尔质量=1.4285g/L×22.4L/mol=32g/mol,则E为O元素;C与元素E处于同一周期且电负性仅次于E,则C为N元素;D位于第三周期且第一电离能最小,则D为Na;F是生活中常用的金属,在空气中表面通常形成一层致密的氧化膜,则F为Al.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级未半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键的为NaOH,由钠离子与氢氧根离子构成;F的氧化物为氧化铝,与NaOH溶液反应生成偏铝酸钠与水;
的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲为N2H4,甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.
已知:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②N2H4(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
根据盖斯定律,②×2-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);
(4)根据方程式计算平衡时各组分物质的量,进而计算氨气体积分数;
若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与原平衡相同,为等效平衡,满足氮气与氢气的起始投料比为1:4.
解答 解:单质A为相同条件下密度最小的气体,则A为H元素;B基态原子最外层电子排布式为nsnnpn,s能级容纳2个电子,则n=2,故B为碳元素;E的单质为双原子分子,在标准状况下密度为1.4285g/L,则其摩尔质量=1.4285g/L×22.4L/mol=32g/mol,则E为O元素;C与元素E处于同一周期且电负性仅次于E,则C为N元素;D位于第三周期且第一电离能最小,则D为Na;F是生活中常用的金属,在空气中表面通常形成一层致密的氧化膜,则F为Al.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>N>O,同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素原子2p能级未半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能N>O>C,
故答案为:Na>N>O;N>O>C;
(2)A(H)、D(Na)、E(O)中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键的为NaOH,其电子式为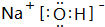 ;F的氧化物为氧化铝,既可以和强酸反应也可以和强碱反应,与NaOH溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
;F的氧化物为氧化铝,既可以和强酸反应也可以和强碱反应,与NaOH溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案为: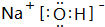 ;Al2O3+2OH-=2AlO2-+H2O;
;Al2O3+2OH-=2AlO2-+H2O;
(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲为N2H4,甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.
已知:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7kJ•mol-1
②N2H4(g)+O2 (g)═N2(g)+2H2O(g)△H2=-534kJ•mol-1
根据盖斯定律,②×2-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1;
(4)已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则:
N2(g)+3H2(g)?2NH3(g)
起始量(mol):1 4 0
变化量(mol):0.5a 1.5a a
平衡量(mol):1-0.5a 4-1.5a a
则达到平衡后,NH3在混合气体中的体积分数为$\frac{amol}{(1-0.5a+4-1.5a+a)mol}$=$\frac{a}{5-a}$;
若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,为等效平衡,满足氮气与氢气的起始投料比为1:4,设加入氨气为xmol,则(2+0.5x):(10+1.5x)=1:4,解得x=4,
故答案为:$\frac{a}{5-a}$;4.
点评 本题考查结构性质位置关系应用、化学平衡有关计算、热化学方程式书写、元素周期律等,明确元素种类是关键,注意同周期第一电离能异常情况.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
| A. | 光导纤维和计算机芯片的材料都是二氧化硅 | |
| B. | 蛋白质只含C、H、O、N四种元素 | |
| C. | 可用酸性高锰酸钾溶液除去乙烷中的乙烯 | |
| D. | 液溴易挥发,在存放液溴的试剂瓶中应加水“液封” |

下列判断正确的是( )
| A. | 气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Al3+、Fe2+、NH4+、NO3- | |
| D. | 溶液中一定不存在大量的Na+ |
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
| A. | 氯丁烷 | B. | 苯 | C. | 硝基苯 | D. | 甘油 |
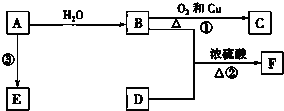 已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.
已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍.现以A为主要原料合成F和高分子化合物E,其合成路线如图所示.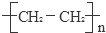 ,反应类型:加聚反应.
,反应类型:加聚反应.