题目内容
16.下列关于强、弱电解质的叙述错误的是( )| A. | 强电解质在水溶液中完全电离成阴、阳离子 | |
| B. | 在溶液中,导电能力强的电解质是强电解质 | |
| C. | 纯净的强电解质在液态时,有的导电,有的不导电 | |
| D. | 对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同 |
分析 A.完全电离的电解质是强电解质,部分电离的电解质是弱电解质;
B.电解质溶液导电性强弱与离子浓度有关;
C.含有自由移动离子的电解质能导电;
D.电解质溶液导电性强弱与离子浓度有关.
解答 解:A.完全电离的电解质是强电解质,部分电离的电解质是弱电解质,所以强电解质在水溶液中完全电离生成阴阳离子,故A正确;
B.电解质溶液导电性强弱与离子浓度有关,与电解质强弱无关,导电能力强的电解质溶液可能是弱电解质溶液,如浓氨水导电能力大于很稀的NaOH,故B错误;
C.含有自由移动离子的电解质能导电,强电解质离子晶体不导电,熔融状态下离子晶体导电,故C正确;
D.电解质溶液导电性强弱与离子浓度有关,所以对同一弱电解质来说,当溶液的温度和浓度不同时,其离子浓度不同,所以其导电能力也不相同,故D正确;
故选B.
点评 本题考查电解质强弱判断,为高频考点,明确强弱电解质根本区别是解本题关键,电解质强弱与电解质溶液导电能力无关,与电解质溶解度大小无关,为易错题.

练习册系列答案
相关题目
6.《三国志•诸葛亮传》记载了蜀汉丞相孔明南征孟获的战争中,蜀军误喝哑泉中毒,后经当地一老叟指点,蜀军喝了当地的安乐泉便脱离了危险,当代化学工作者对哑泉进行了考察,发现哑泉含有硫酸铜,安乐泉味苦,呈碱性,下列说法中不正确的是( )
| A. | 硫酸铜有毒 | B. | 硫酸铜溶液是蓝色的胶体 | ||
| C. | 硫酸铜为电解质 | D. | 解毒的原因是Cu2+转化为沉淀 |
4.铜与稀硝酸反应,不能生成的物质是( )
| A. | Cu(NO3)2 | B. | NO | C. | H2O | D. | H2 |
11.“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10mol•L-1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
请回答下列问题:
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 产生气体 | 无气体 |
(1)配制0.10mol•L-1的稀盐酸250mL,需要10.0mol•L-1的浓盐酸的体积为2.5mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
1.用情性电极电解以下溶液,下列说法正确的是( )
| A. | 电解NaOH溶液时,溶液浓度将增大,pH增大 | |
| B. | 电解H2SO4溶液时,溶液浓度将增大,pH增大 | |
| C. | 电解Na2SO4溶液时,溶液浓度将增大,pH不变 | |
| D. | 电解NaCl溶液时,溶液浓度将减小,pH不变 |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 质量都为4.4g的CH3CHO和CO2含有的分子数均为0.1NA | |
| B. | 1molNa2O2中的离子总数为4NA | |
| C. | 密闭容器中,2molSO2和足量的O2反应转移的电子数为4NA | |
| D. | 1mol苯分子中所含的碳碳双键数为3NA |
5.依据如图判断,下列说法正确的是( )


| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
6.部分中学化学常见元素的原子结构和性质如下表所示:
请回答下列问题:(所有问题答案都要用元素符号或化学式表示)
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式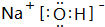 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式
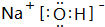 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.