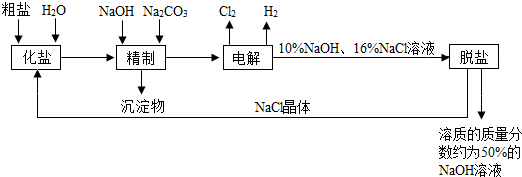
题目内容
11.甲、乙两个密闭容器中均发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g)△H>0.有关实验数据如下表所示:容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 3.5 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 | K2 |
| A. | T1<T2 | |
| B. | K2=1.35 mol•L-1(或K2=1.35) | |
| C. | 混合气体的密度始终保持不变 | |
| D. | 乙容器中,当反应进行到1.5 min时,n(H2O)=1.4 mol. |
分析 A.运用平衡移动的原理来分析温度的高低;
B.利用三段式计算平衡时各组分的物质的量,再根据平衡常数K2计算;
C.该反应有固体参与,因此反应不平衡,气体的质量就会变化,根据ρ=$\frac{m}{V}$分析;
D.随反应进行,物质的浓度降低,反应速率较短,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量.
解答 解:A.两者反应物浓度相等,甲相对乙,甲平衡时H2(g)平衡量为2.4mol,实际上是3.2mol,说明温度改变平衡正向移动,而正反应为吸热反应,所以T1>T2,故A错误;
B.由表中数据可知,平衡时氢气的物质的量为1.2mol,则:
C(s)+2H20(g)?C02(g)+2H2(g)
开始(mol):1 2 0 0
转化(mol):0.6 1.2 0.6 1.2
平衡(mol):0.4 0.8 0.6 1.2
平衡常数K2=$\frac{0.6×1.{2}^{2}}{0.{8}^{2}}$=1.35,故B正确;
C.该反应有固体参与,因此反应不平衡,气体的质量就会变化,气体的体积不变,由$ρ=\frac{m}{V}$可知混合气体的密度是变量,故C错误;
D.3min内水蒸气的浓度变化量=氢气的浓度变化量的=$\frac{1.2mol}{1L}$=1.2mol/L,随反应进行,物质的浓度降低,反应速率变小,故前1.5min水的浓度变化量大于后1.5min水的浓度变化量,故反应进行到1.5min时,H2O(g)的物质的量浓度小于2mol/L-1.2mol/L×$\frac{1}{2}$=1.4mol/L,故D错误;
故选B.
点评 本题考查化学平衡,为高频考点,综合性较强,题目难度中等,其中化学平衡的影响因素和化学平衡常数的计算是难点.

 阅读快车系列答案
阅读快车系列答案| A. | 电解NaOH溶液时,溶液浓度将增大,pH增大 | |
| B. | 电解H2SO4溶液时,溶液浓度将增大,pH增大 | |
| C. | 电解Na2SO4溶液时,溶液浓度将增大,pH不变 | |
| D. | 电解NaCl溶液时,溶液浓度将减小,pH不变 |
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
(1)C、D、E的原子半径由大到小的顺序为Na>N>O,B、C、E的第一电离能由大到小的顺序为N>O>C.
(2)A、D、E中的某些元素间可以形成多种化合物,其中有一种既含有离子键又含有极性共价键,写出其电子式
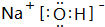 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.(3)由A和C可以形成多种化合物,其中一种为六原子化合物甲(C2A4),甲可用作发射卫星时的燃料,用NO2为氧化剂时,这两种物质反应生成氮气和水蒸气.已知:
①N2(s)+2O2(g)=2NO2(g)△H1=+67.7kJ•mol-1
②甲(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ•mol-1
写出甲与NO2反应的热化学方程式2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1.
(4)在一容积固定的密闭容器中模拟工业制取NH3的反应N2+3H2$?_{高温高压}^{催化剂}$2NH3,并保持温度不变,已知初始加入1molN2和4molH2,且达到平衡后生成amolNH3,则达到平衡后,NH3在混合气体中的体积分数为$\frac{a}{5-a}$;若在恒温恒压的实验条件下,若改为加入2molN2和10molH2,要求平衡后NH3的质量分数与上次相同,在还应加入4molNH3.
| A. | 5种 | B. | 9种 | C. | 14种 | D. | 16种. |
| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
Ⅰ.菠菜中富含可溶性草酸盐,易与豆腐中的钙盐形成不溶于水能溶于稀硫酸的草酸钙(CaC2O4)
Ⅱ.有关专家建议食用高草酸蔬菜的同时,适当摄入高钙食物,使二者在肠道内结合成草酸钙沉淀,并随着大便排出体外.以免草酸进入血液中与人体内的血钙结合,形成血液中的草酸钙需经肝脏、肾脏、尿道,随着小便排出体外,大量草酸钙流经肾脏,提升了泌尿系统结石的风险.
Ⅲ.草酸(H2C2O4)具有较强的还原性.回答下列问题:
(1)该活动小组的同学取m g菠菜样品在研钵中研磨成汁,用足量热的稀硫酸溶液浸泡,最后过滤(填操作名称)得到澄清溶液.
(2)将溶液转入容量瓶中并加水配制成250mL溶液A.
(3)用滴定法测定草酸盐的含量.
①量取待测溶液A 20.00mL于锥形瓶中,置于铁架台的白纸上.
②用酸式滴定管(填仪器名称)盛装0.1000mol/LKMnO4标准溶液进行滴定时:眼睛注视锥形瓶中溶液颜色变化;当溶液由无色变红,且30s内不恢复原色时,停止滴定,并记录KMnO4标准溶液的终读数.重复滴定3次.
(4)KMnO4滴定待测溶液A时发生反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,根据下表实验数据计算菠菜中草酸盐
(以C2O42-计算)的质量分数为(可以只列式不化简)$\frac{5.5g}{mg}$×100%.
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
A.配制溶液时未洗涤烧杯和玻璃棒 B.锥形瓶未干燥就直接加入待测液
C.未用标准液润洗盛装标准液的仪器就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失 E.滴定后俯视读数.
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
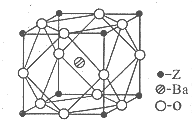 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知: