题目内容
2.按要求回答下列问题:(1)
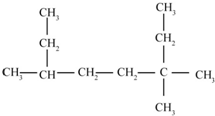 的名称为3,3,6-三甲基辛烷
的名称为3,3,6-三甲基辛烷 (2)
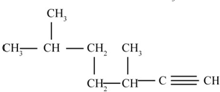 的名称为3,6-二甲基-1-庚炔
的名称为3,6-二甲基-1-庚炔(3)?二氯甲苯的结构简式为
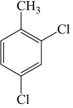 .
.(4)某物质结构如图所示
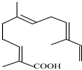 ,其分子式为C15H22O2.
,其分子式为C15H22O2.
分析 (1)该有机物为烷烃,选取最长碳链为主链,然后从取代基编号之和最长的一端编号,先写出取代基位置,在写出主链名称;
(2)该有机物为炔烃,选取含有碳碳三键的最长碳链为主链,然后从距离碳碳三键最近的一端开始编号,命名中需要标出碳碳三键的位置;
(3)二氯甲苯是甲苯分子中的苯环上有两个氯原子,可以写出多种结构简式;
(4)根据图示的有机物结构简式写出分子式,该有机物分子中含有15个C、22个H和2个O.
解答 解:(1)选取最长碳链为主碳链含8个碳原子,离取代基近的一端给主碳链编号写,在3号碳有两个甲基,在6号碳有一个甲基,写出名称为:3,3,6-三甲基辛烷,故答案为:3,3,6-三甲基辛烷;
(2)选取含碳碳三键在内的最长碳链为主碳链,含7个碳原子,离三键进的一端给主碳链编号确定取代基和三键位置,名称为:3,6-二甲基-1-庚炔,故答案为:3,6-二甲基-1-庚炔;
(3)二氯甲苯是甲苯分子中的苯环上有两个氯原子,可以写出多种结构简式,其中可以是2,4-二氯甲苯,结构简式为: ,故答案为:
,故答案为: ;
;
(4)该有机物分子中含有15个C、22个H和2个O,该有机物的分子式为:C15H22O2,故答案为:C15H22O2.
点评 本题考查了有机物结构与性质,题目难度中等,充分考查了学生对所学知识的掌握情况,注意掌握常见有机物结构与性质,明确有机物命名原则,能够正确书写常见有机物的结构简式.

练习册系列答案
相关题目
2.20℃时,饱和NaCl溶液的密度为1.12g•cm-3,质量分数是26.5%,则下列说法正确的是( )
| A. | 该饱和溶液的物质的量浓度为5.07mol•L-1 | |
| B. | 向该溶液中加入等体积的水之后溶液的质量分数小于13.25% | |
| C. | 25℃时,密度等于1.12g•cm-3的NaCl溶液是饱和溶液 | |
| D. | 将此溶液蒸发掉部分水,再恢复到20℃时,溶液密度一定大于1.12g•cm-3 |
10.铁是人体必需元素,是合成血红素的重要原料,缺铁会造成贫血,市场上常见补血剂有硫酸亚铁、富马酸亚铁(分子式C4H2O4Fe)、葡萄糖酸亚铁、琥珀酸亚铁(速力菲片)等.某化学兴趣小组通过实验对硫酸亚铁补血剂成分进行探究并测定Fe2+的含量,可供选择的试剂有双氧水、KSCN溶液、盐酸、BaCl2溶液(已知KSCN可被双氧水氧化).
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
(2)配制硫酸亚铁补血剂的待测溶液.
补血剂(1片0.5克)$\stackrel{①溶解}{→}$浊液$→_{③}^{②脱色}$滤液$\stackrel{④氧化}{→}$配成1L待测液
①步骤③浊液脱色后进行A(填标号)操作才能得到溶液.

②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是因为硫酸亚铁在加热过程中易被氧化,,你的方案是加入足量铁粉,小心蒸发至出现结晶膜时停止加热.
③已知步骤④中加入足量的H2O2溶液,作用是将Fe2+完全氧化成Fe3+,然后微热并用玻璃棒搅拌至无气泡产生,目的是除去过量的H2O2.
④写出步骤④中发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)测定硫酸亚铁补血剂待测液的浓度
【方法一】用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图.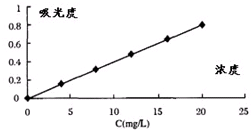
⑤取待测液10mL滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是12%.
【方法二】KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2mol•L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL.
⑥KMnO4溶液置于酸式滴定管中,终点的颜色变化:浅绿色变成浅黄色
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是维生素C具有还原性,防止Fe2+被氧化.
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |
补血剂(1片0.5克)$\stackrel{①溶解}{→}$浊液$→_{③}^{②脱色}$滤液$\stackrel{④氧化}{→}$配成1L待测液
①步骤③浊液脱色后进行A(填标号)操作才能得到溶液.

②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是因为硫酸亚铁在加热过程中易被氧化,,你的方案是加入足量铁粉,小心蒸发至出现结晶膜时停止加热.
③已知步骤④中加入足量的H2O2溶液,作用是将Fe2+完全氧化成Fe3+,然后微热并用玻璃棒搅拌至无气泡产生,目的是除去过量的H2O2.
④写出步骤④中发生反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(3)测定硫酸亚铁补血剂待测液的浓度
【方法一】用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图.

⑤取待测液10mL滴加5mL 0.2mol•L-1 苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是12%.
【方法二】KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2mol•L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL.
⑥KMnO4溶液置于酸式滴定管中,终点的颜色变化:浅绿色变成浅黄色
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是维生素C具有还原性,防止Fe2+被氧化.
12.下列各类烃中,碳氢两元素的质量比为定值的是( )
| A. | 烷烃 | B. | 烯烃 | C. | 炔烃 | D. | 苯的同系物 |





 2,3-二甲基戊烷,C7H16;
2,3-二甲基戊烷,C7H16; 2,3,3-三甲基戊烷,C8H18.
2,3,3-三甲基戊烷,C8H18.