题目内容
6.下列有关说法不正确的是( )| A. | 胶体的丁达尔效应与微粒直径大小有关 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | 可用半透膜除去淀粉溶液中的少量NaCl | |
| D. | 向饱和氯化钠溶液中加入一小块钠,恢复原温度后溶液中有固体析出 |
分析 A.在光的传播过程中,光线照射到粒子时,如果粒子大于入射光波长很多倍,则发生光的反射;如果粒子小于入射光波长,则发生光的散射;
B.明矾不具有强氧化性;
C.胶粒不能透过半透膜;
D.钠固体与饱和氯化钠溶液中的水反应,饱和溶液中溶剂减少.
解答 解:A.当可见光透过胶体时会产生明显的散射作用,故A正确;
B.明矾不具有强氧化性,可净化水,但不能消毒,故B错误;
C.淀粉溶液是胶体,胶粒不能透过半透膜,可用半透膜除去淀粉溶液中的少量NaCl,故C正确;
D.钠固体与饱和氯化钠溶液中的水反应,饱和溶液中溶剂减少,则会有氯化钠固体析出,则出现浑浊,故D正确.
故选B.
点评 本题考查胶体性质、盐类水解、溶液饱和性和钠与水的反应,题目难度不大,注意饱和溶液中晶体析出的分析,明矾净水的原理是吸附作用.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
16.向盛有10滴AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成;继续向试管中滴加0.1mol/L KI溶液并振荡,沉淀变为黄色;再向试管中滴入0.1mol/L Na2S溶液并振荡,沉淀又变成黑色.根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |
17.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
14.一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2+9H2O,在反应中被氧化与被还原的氨原子数之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
11.茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )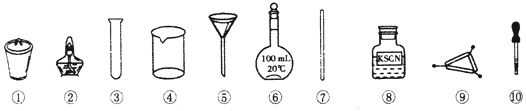

| A. | 将茶叶灼烧灰化,选用②、④和⑨ | |
| B. | 用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④和⑦ | |
| C. | 过滤得到滤液,选用④、⑤和⑦ | |
| D. | 检验滤液中的Fe3+,选用③、⑧和⑩ |
15.“生物质能”主要是指树木、庄稼、草类等植物直接或间接提供的能量;古老的柴火做饭、烧炭取暖等粗放用能方式正被现代科学技术所改变,下面说法错误的是( )
| A. | 生物质能的缺点是严重污染环境 | |
| B. | 生物质能源是可再生的能源 | |
| C. | 利用生物质能就是间接利用太阳能 | |
| D. | 使用沼气这种生物质能是对化学能的充分利用 |
12.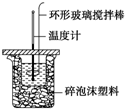 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热△H=-51.8kJ•mol-1(结果保留一位小数).
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的 酸用水冲洗干净;②用另一量筒量取50mL 0.55mol•L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1g•cm-3,又知中和反应后生成溶液的比热容c=4.18J•g-1•℃-1.为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(3)不能(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热.