题目内容
7.如图是实验室制取SO2并验证SO2某些性质的装置图.试用实验现象和性质填空: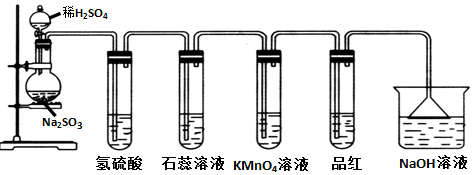
(1)氢硫酸中产生黄色沉淀,证明SO2有氧化性
(2)石蕊溶液变红
(3)KMnO4溶液紫红色褪去,证明SO2有还原性
(4)品红溶液褪色,证明SO2有漂白性,加热所得溶液出现的实验现象是:恢复红色,
(5)NaOH溶液的作用是吸收多余的SO2防止污染环境.说明SO2是酸性氧化物.
分析 Na2SO3固体与硫酸可发生反应:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,
(1)二氧化硫与氢硫酸反应生成单质硫;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸;酸可以使紫色石蕊试液变红;
(3)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性;
(4)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,生成无色不稳定的大分子;
(5)二氧化硫是大气污染物,所以用NaOH溶液的作用是吸收多余的SO2防止污染环境,二氧化硫与氢氧化钠生成亚硫酸钠和水.
解答 解:(1)二氧化硫与氢硫酸反应生成单质硫,所以观察到产生黄色沉淀,体现二氧化硫的氧化性,故答案为:黄色沉淀; 氧化性;
(2)二氧化硫溶于水和水反应生成亚硫酸,亚硫酸为弱酸,可以使紫色石蕊试液变红,故答案为:变红;
(3)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性,二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:紫红色褪去;还原;
(4)二氧化硫与品红化合生成无色物质,能使品红溶液褪色,故二氧化硫具有漂白性,加热所得溶液出现的实验现象是:恢复红色,故答案为:褪色;漂白;恢复红色;
(5)二氧化硫是大气污染物,所以用NaOH溶液的作用是吸收多余的SO2防止污染环境,二氧化硫与氢氧化钠生成亚硫酸钠和水,说明SO2是酸性氧化物,故答案为:吸收多余的SO2防止污染环境;酸性.
点评 本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、氧化性和还原性等是解题关键,题目难度中等.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目
18.下列叙述正确的是(均在常温下)( )
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
18. 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
15.分子式为C5H10O2,且可以发生水解反应的同分异构体有( )种.
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
2.下列关于如图所示电化学装置的分析正确的是( )


| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
19.等量的X(C5H8O4) 分别与足量的碳酸氢钠、钠反应生成的气体的物质的量之比2:1,则X可能的结构(不考虑立体异构)共有( )
| A. | 2种 | B. | 3种 | C. | 4 种 | D. | 5种 |
16.向盛有10滴AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成;继续向试管中滴加0.1mol/L KI溶液并振荡,沉淀变为黄色;再向试管中滴入0.1mol/L Na2S溶液并振荡,沉淀又变成黑色.根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |
17.某离子反应涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中c(NH4+)随反应进行逐渐减小.下列判断错误的是( )
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |