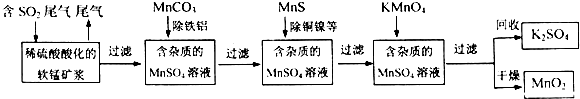
题目内容
10.下列不属于正在研究和开发的新能源是( )| A. | 天然气 | B. | 生物质能 | C. | 氢能 | D. | 太阳能 |
分析 新能源又称非常规能源,是指传统能源之外的各种能源形式.是指刚开始开发利用或正在积极研究、有待推广的能源,如太阳能、地热能、氢能、风能、潮汐能、生物质能等.
解答 解:根据新能源的含义,生物质能、氢能、太阳能都属于新能源,天然气是传统能源;
故选A.
点评 本题考查新能源概念,需要了解各种能源的来源和含义,难度较小,解决此题主要依靠识记集中新能源的类型,并且知道什么是常规能源,注意基础知识的积累掌握.

练习册系列答案
相关题目
20.某同学设计如下元素周期表,下列说法正确的是( )
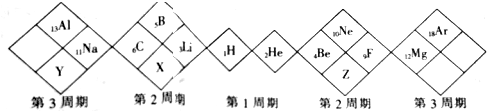

| A. | X元素最高价氧化物对应的水化物为弱酸 | |
| B. | Y元素最外层电子数是最内层电子数的2倍 | |
| C. | 原子半径:Y>X>Z | |
| D. | X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
1.下列说法正确的是( )
| A. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| B. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
18.下列有关化学用语表述正确的是( )
| A. | S2-的结构示意图: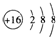 | B. | 中子数为10的氧原子:${\;}_{18}^{8}$O | ||
| C. | HClO的电子式: | D. | 硝基苯的结构简式: |
5.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀中不含有CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
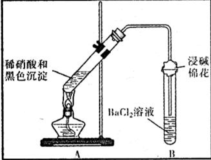 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
2.下列所述事实与化学(或离子)方性式不相符的是( )
| A. | 能说明H2CO3是弱电解质:HCO3-+H2O?H2CO3+OH- | |
| B. | 能说明溶解性AgCl强于AgI:AgCl+I-═Cl-+AgI | |
| C. | 能说明盐酸是强酸:HCl+AgNO3═AgCl↓+HNO3 | |
| D. | 能说明NH3结合H+能力比H2O强:NH3+H3O+═NH4++H2O |
11.某酒精检测仪是以酸性燃料电池原理设计的,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法不正确的是( )
| A. | 检测时,电解质溶液中的H+向正极移动 | |
| B. | 若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 | |
| C. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |