题目内容
12.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )| A. | pH值为1的溶液 Fe3+、NH4+、Cl-、SO42- | |
| B. | 滴加石蕊试液显红色的溶液 Fe2+、Na+、Mg2+、NO3- | |
| C. | 水电离出来的c(H+)=10-13 mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| D. | 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ |
分析 A.pH值为1的溶液,显酸性;
B.滴加石蕊试液显红色的溶液,显酸性;
C.水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液;
D.离子之间相互促进水解.
解答 解:A.pH值为1的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.滴加石蕊试液显红色的溶液,显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能共存,故B错误;
C.水电离出来的c(H+)=10-13 mol/L的溶液,为酸或碱溶液,酸、碱溶液中均不能大量存在HCO3-,故C错误;
D.CO32-、Al3+相互促进水解,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列不属于正在研究和开发的新能源是( )
| A. | 天然气 | B. | 生物质能 | C. | 氢能 | D. | 太阳能 |
3.分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程示意图如所示.
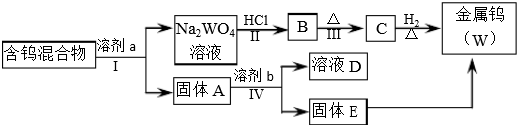
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是过滤.
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是Na2WO4+2HCl=H2WO4+2NaCl、H2WO4$\frac{\underline{\;\;△\;\;}}{\;}$WO3+H2O.
(3)WO3既属于金属氧化物,也属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O.
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是将WO3溶解同时又能保证不被氧化W2O5.
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是50g/L Na2CO3溶液,固体E中含有的物质是W、WO2,D中溶质是Na2WO4.
20. A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表
请根据表中的信息回答下列问题:
(1)D离子的结构示意图: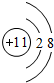 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: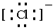 .
.
(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
 A~D是原子序数在20以内的元素,其性质或结构信息如下表
A~D是原子序数在20以内的元素,其性质或结构信息如下表| 元素 | A | B | C | D | E |
| 性质或 结构 信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 地壳中含量最多的金属元素 | 其单质和化合物的焰色反应均为黄色 | 单质在常温、常压下是黄绿色气体 |
(1)D离子的结构示意图:
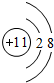 ,B原子的电子式:
,B原子的电子式: ,E离子的电子式:
,E离子的电子式: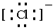 .
.(2)写出和B的氢化物所含电子数相同的3种微粒:CH4,H2O,HF.
(3)A元素与E元素组成的化合物的电离方程式:HCl=H++Cl-.
(4)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是钾元素的(平均)相对原子质量;钾元素的离子的电子式K+.
(5)硼(B)有两种同位素${\;}_{5}^{10}$B和${\;}_{5}^{11}$B,它们的原子百分数分别为19.7%和80.3%,则硼的平均相对原子质量为:10×19.7%+11×80.3%(只需列出式子,不必计算出结果 ).
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,1.12LCCl4含有Cl原子数目为0.4NA | |
| B. | 标准状况下,2.24L氯气中含有的电子总数为3.4mol | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 39gNa2O2与足量H2O反应,转移电子数为NA |
2.下列说法正确的是( )
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 高纯度的硅单质用于制作光导纤维 |
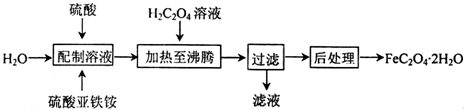

 .
.