题目内容
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 49 | ||||
| 1s22s22p6 | ||||
| 3d54s1 | ||||
| 6 | ⅡB |
考点:原子核外电子排布,元素周期表的结构及其应用
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:原子序数等于核外电子数,根据能量最低原理书写电子排布式,最大能层数等于周期序数,族序数由价电子数决定.
解答:
解:原子序数49,说明原子核外电子数为49,根据构造原理、洪特规则特例得到电子排布式为1s2 2s22p6 3s23p63d10 4s24p64d10 5s25p1,价电子排布式为5s25p1,最大能层数为5,说明处于第五周期,价电子数为3个,说明处于第ⅢA族;
由电子排布式可知,原子序数=核外电子数=10,价电子排布式为2s22p6,最大能层数为2,价电子数为8,位于第二周期0族;
价电子排布式补齐前面的电子排布为1s2 2s22p6 3s23p63d5 4s1,原子序数=核外电子数=24,最大能层数为4,价电子数为6,位于第四周期ⅥB族;
第六周期、第ⅡB族位于ds区,说明其价电子排布为4f145d106s2,原子核外电子排布式为1s2 2s22p6 3s23p63d10 4s24p64d10 4f14 5s25p65d106s2,原子序数=核外电子数=80;
故答案为:
由电子排布式可知,原子序数=核外电子数=10,价电子排布式为2s22p6,最大能层数为2,价电子数为8,位于第二周期0族;
价电子排布式补齐前面的电子排布为1s2 2s22p6 3s23p63d5 4s1,原子序数=核外电子数=24,最大能层数为4,价电子数为6,位于第四周期ⅥB族;
第六周期、第ⅡB族位于ds区,说明其价电子排布为4f145d106s2,原子核外电子排布式为1s2 2s22p6 3s23p63d10 4s24p64d10 4f14 5s25p65d106s2,原子序数=核外电子数=80;
故答案为:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 1s2 2s22p6 3s23p63d10 4s24p64d10 5s25p1 | 5s25p1 | 5 | ⅢA | |
| 10 | 2s22p6 | 2 | 0 | |
| 24 | 1s2 2s22p6 3s23p63d5 4s1 | 4 | ⅥB | |
| 80 | 1s2 2s22p6 3s23p63d10 4s24p64d10 4f14 5s25p65d106s2 | 4f145d106s2 |
点评:本题考查了原子核外电子排布和周期表位置的关系,难度一般,根据元素的原子序数便可以写出原子的电子排布式,但是要注意洪特规则,既有些元素例如铜,银,金等其价电子会重排,使得各个电子层达到全充满或者半充满状态,这样能量比较低,构型稳定.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
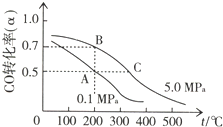
一定温度下,在2L的密闭容器中加入4molA和6molB,发生如下反应:2A(g)+3B(g)?4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L.下列说法正确的是( )
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
P轨道电子云形状正确叙述为( )
| A、球形对称 |
| B、对顶双球 |
| C、在X.Y.Z轴上的纺锤形 |
| D、互相垂直的梅花瓣形. |
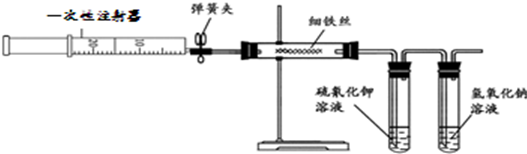
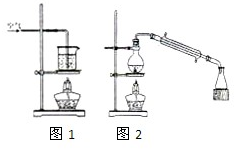 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.