题目内容
现有 A、B、C、D、E五瓶无色溶液分别是HC1、BaCl2、NaHSO4、K2CO3、AgNO3溶液中的一种,已知:
①A与B反应有气体产生
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体产生
⑥在②、③反应中生成的沉淀为同一种物质.
请填写下列空白:(1)A是 ,B是 ,D是 .
(2)写出⑤反应的离子方程式 .
(3)将 0.1mol/L 的 Ba(OH)2溶液与 0.1mol/L 的E溶液按下表中的不同配比进行混合:
①按丁方式混合后,所得溶液显 (填“酸““碱““中“)性.
②按乙方式混合时,反应的离子方程式为 .
①A与B反应有气体产生
②B与C反应有沉淀生成
③C与D反应有沉淀生成
④D与E反应有沉淀生成
⑤A与E反应有气体产生
⑥在②、③反应中生成的沉淀为同一种物质.
请填写下列空白:(1)A是
(2)写出⑤反应的离子方程式
(3)将 0.1mol/L 的 Ba(OH)2溶液与 0.1mol/L 的E溶液按下表中的不同配比进行混合:
| 甲 | 乙 | 丙 | 丁 | 戊 | |
| 0.1mol/L 的 Ba(OH)2溶液的体积/mL | 10 | 10 | 10 | 10 | 10 |
| 0.1mol/L 的E溶液的体积/mL | 5 | 10 | 15 | 20 | 25 |
②按乙方式混合时,反应的离子方程式为
考点:无机物的推断
专题:
分析:根据信息①⑤反应有气体,气体只能为CO2,则A为K2CO3,其余,先分组:
B、E组为HCl、NaHSO4,那么C、D组为AgNO3、BaCl2,
据信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为HCl,以此解答该题.
B、E组为HCl、NaHSO4,那么C、D组为AgNO3、BaCl2,
据信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为HCl,以此解答该题.
解答:
解:根据信息①⑤反应有气体,气体只能为CO2,则A为K2CO3,其余先分组:
B、E组为HCl、NaHSO4,那么C、D组为AgNO3、BaCl2,
据信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为HCl,
(1)由以上分析可知A为K2CO3,B为HCl,D为BaCl2,故答案为:K2CO3;HCl;BaCl2;
(2)⑤为K2CO3和NaHSO4的反应,离子方程式为CO32-+2H+=H2O+CO2↑,故答案为:CO32-+2H+=H2O+CO2↑;
(3)将 0.1mol/L 的 Ba(OH)2溶液与 0.1mol/L 的NaHSO4溶液按下表中的不同配比进行混合,
当按1:2(丁)混合时,发生Ba2++2OH-+SO42-+2H+=2H2O+BaSO4↓,反应后溶液呈中性,
如按1:1(乙)混合,则发生 Ba2++OH-+SO42-+H+=H2O+BaSO4↓,
故答案为:中; Ba2++OH-+SO42-+H+=H2O+BaSO4↓.
B、E组为HCl、NaHSO4,那么C、D组为AgNO3、BaCl2,
据信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为HCl,
(1)由以上分析可知A为K2CO3,B为HCl,D为BaCl2,故答案为:K2CO3;HCl;BaCl2;
(2)⑤为K2CO3和NaHSO4的反应,离子方程式为CO32-+2H+=H2O+CO2↑,故答案为:CO32-+2H+=H2O+CO2↑;
(3)将 0.1mol/L 的 Ba(OH)2溶液与 0.1mol/L 的NaHSO4溶液按下表中的不同配比进行混合,
当按1:2(丁)混合时,发生Ba2++2OH-+SO42-+2H+=2H2O+BaSO4↓,反应后溶液呈中性,
如按1:1(乙)混合,则发生 Ba2++OH-+SO42-+H+=H2O+BaSO4↓,
故答案为:中; Ba2++OH-+SO42-+H+=H2O+BaSO4↓.
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质的性质结合反应的现象进行推断,学习中注意把握常见元素化合物的性质.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
实验室需480mL 1.0mol/L的NaOH溶液,假如其他操作均是准确无误的,下列情况会引起配制溶液的浓度偏高的是( )
| A、称取氢氧化钠20.0 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解氢氧化钠的烧杯没有进行冲洗 |
| D、移液用玻璃棒引流时,玻璃棒下端靠在容量瓶刻度线上方 |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH中的H+数目 |
| B、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH的电离常数 |
| C、在4NH3+6NO═5N2+6H2O反应中,被氧化和被还原的N原子数 |
| D、纯水在25℃和80℃时的pH |
有关下列物质分子结构特征描述正确的是( )
| A、乙烯分子中碳、氢原子个数比为1:2,证明乙烯分子里含有一个碳碳双键 |
B、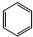 表示苯分子的结构,因此能解释邻二甲苯有 表示苯分子的结构,因此能解释邻二甲苯有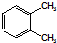 和 和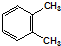 两种结构 两种结构 |
C、因为甲烷是一种正四面体结构,所以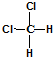 和 和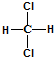 属于同一种物质 属于同一种物质 |
| D、苯的分子式是C6H6,分子式中碳原子远没有饱和,因此苯能使溴水褪色 |
长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是( )
| A、冰毒、黄连素 |
| B、海洛因、阿司匹林 |
| C、大麻、摇头丸 |
| D、尼古丁、青霉素 |
下列有关分子的结构和性质的说法中正确的是( )
| A、PCl3和SO2都是极性分子 |
| B、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| C、BF3、NCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| D、凡是中心原子采取sp3杂化轨道形成的分子其几何构型都是正四面体 |
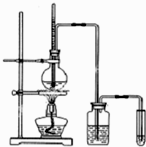 下面是实验室制乙烯并检验其性质的装置图,请回答:
下面是实验室制乙烯并检验其性质的装置图,请回答: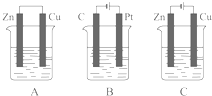 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.