题目内容
6.洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在.有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(以让碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘.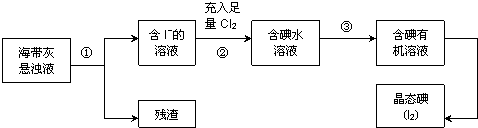
(1)灼烧海带时需要用到的实验仪器是ACDE(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.坩埚 B.坩埚钳 C.三脚架 D.泥三角E.酒精灯
(2)过程②中充入足量Cl2的目的是将I-全部氧化为I2,反应的离子方程式为Cl2+2I-=2Cl-+I2.
(3)操作③中所用的有机试剂可以是苯(只填一种).
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选)加入分液漏斗中,盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,不时旋开活塞放气,后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是平衡压力便于液体流出;
b.最后碘的有机溶液是通过漏斗上口获得(填“漏斗上口”或“漏斗下口”).
(5)若要检验提取碘后的水溶液中是否还含有单质碘,可以取样加入淀粉溶液,观察颜色变化.
(6)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察图所示实验装置,指出其错误有3处.

分析 将海带灼烧,然后将海带灰浸泡,采用过滤方法分离得到残渣,滤液中含有I-,向滤液中充入少量Cl2,发生反应2 I-+Cl2=I2+2Cl-,得到含有碘的水溶液,向碘水中加入萃取剂得到含碘有机溶液,最后采用蒸馏方法得到晶体碘单质,
(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热;
(2)过程②中充入足量Cl2的目的是将I-全部氧化为I2;
(3)萃取剂的选取标准是:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂和原溶剂不互溶;
(4)其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体;
a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,便于液体流出;
b.分液操作分离互不相溶的液体遵循“上吐下泻”的原则;
(5)碘单质遇到淀粉变蓝色;
(6)装置中需要改进的是:垫上石棉网、温度计水银球应与烧瓶支管口相平、冷却水应下进上出;
解答 解:将海带灼烧,然后将海带灰浸泡,采用过滤方法分离得到残渣,滤液中含有I灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热-,向滤液中充入少量Cl2,发生反应2 I-+Cl2=I2+2Cl-,得到含有碘的水溶液,向碘水中加入萃取剂得到含碘有机溶液,最后采用蒸馏方法得到晶体碘单质,
(1)灼烧海带时用坩埚盛放海带,用带铁圈的铁架台或三脚架和泥三角上放置坩埚,用酒精灯进行加热,所以灼烧海带时需要用到的实验仪器是坩埚、带铁圈的铁架台或三脚架、泥三角、酒精灯,选择ACDE,
故答案为:ACDE;
(2)过程②中充入足量Cl2的目的是将I-全部氧化为I2,反应的离子方程式为:Cl2+2I-=2Cl-+I2,
故答案为:将I-全部氧化为I2;Cl2+2I-=2Cl-+I2;
(3)选取的萃取剂可以是苯或四氯化碳,因为溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应,萃取剂和原溶剂不互溶,
故答案为:苯;
(4)其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体,
a.分液漏斗使用时:将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准,可以平衡气压,便于液体流出,
故答案为:平衡压力便于液体流出;
b.分液是下层溶液从下层放出,上层溶液从上口倒出,最后碘的有机溶液是通过:若选苯则填“漏斗上口”,
故答案为:漏斗上口;
(5)提取碘后的水溶液中若是含有单质碘,则遇到淀粉会变蓝色,可以取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘).
故答案为:淀粉溶液;
(6)由图可知,烧瓶加热需要石棉网,温度计水银球应与烧瓶支管口相平,冷却水应下进上出,则错误为缺少石棉网,温度计水银球位置错误,冷凝水水流方向错误,共有三处,
故答案为:3.
点评 本题考查了海水资源的综合利用,为高频考点,涉及知识点较多,把握实验流程及发生的反应、萃取剂的选取标准、蒸馏实验原理及装置等知识点为解答的关键,侧重高频考点的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 金刚石与石墨互为同位素 | |
| B. | 石墨不如金刚石稳定 | |
| C. | 金刚石比石墨能量低 | |
| D. | 等质量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
| 选项 | 溶液 | 离子组 |
| A | 滴加NaOH溶液可产生有刺激性气味的气体的溶液中 | K+、S2-、SO${\;}_{4}^{2-}$、NO3- |
| B | 有HCO${\;}_{3}^{-}$存在的溶液中 | Na+ K+、Cl-、AlO${\;}_{2}^{-}$ |
| C | pH=1的溶液中 | F-、Ca+、NO${\;}_{3}^{-}$、K+ |
| D | 能使紫色石蕊试液变红的溶液中 | Fe2+、MnO4-、NO${\;}_{3}^{-}$、SO42- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 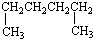 1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 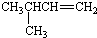 3-甲基丁烯 3-甲基丁烯 | ||
| C. | 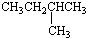 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
| A. | 氯丁烷 | B. | 苯的同系物 | C. | 硝基苯 | D. | 乙醇 |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | H | |||||||
| 2 | C | O | ||||||
| 3 | Na | Mg | Al | Si | S | |||
(2)S元素的最高正化合价是+6.
(3)Na、Mg、Al三种元素的金属性逐渐减弱(填“减弱”或“增强”).
(4)某元素位于元素周期表中第3周期第ⅦA族,该元素的原子结构示意图是c(选填编号).
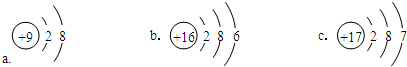
| A. | 四种元素在自然界均不能以游离态存在 | |
| B. | X、Z、W均可形成两种常见氧化物 | |
| C. | 元素X、Y、W的最高化合价均与其族序数相等 | |
| D. | 离子半径:W>Z>Y |
| A | B | C | |
| D |
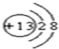
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
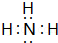 ,Y的结构式为
,Y的结构式为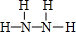
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.

 、C
、C .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. B.
B.
 D.
D.