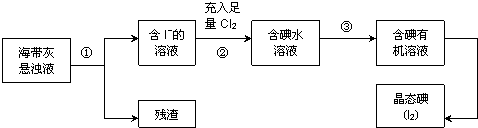
题目内容
2.常温下,下列各组离子在指定的溶液中能够大量共存的是( )| 选项 | 溶液 | 离子组 |
| A | 滴加NaOH溶液可产生有刺激性气味的气体的溶液中 | K+、S2-、SO${\;}_{4}^{2-}$、NO3- |
| B | 有HCO${\;}_{3}^{-}$存在的溶液中 | Na+ K+、Cl-、AlO${\;}_{2}^{-}$ |
| C | pH=1的溶液中 | F-、Ca+、NO${\;}_{3}^{-}$、K+ |
| D | 能使紫色石蕊试液变红的溶液中 | Fe2+、MnO4-、NO${\;}_{3}^{-}$、SO42- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.滴加NaOH溶液可产生有刺激性气味的气体的溶液中,溶液中含有NH4+,非酸性条件下硝酸根没有强氧化性,能与S2-共存,其它离子之间也不发生反应;
B.HCO3-与AlO2-发生水解反应反应生成氢氧化铝沉淀;
C.HF为弱酸,且CaF2不溶于水;
D.能使紫色石蕊试液变红的溶液呈酸性,酸性条件下MnO4-、NO3-具有强氧化性,可以氧化Fe2+.
解答 解:A.滴加NaOH溶液可产生有刺激性气味的气体的溶液中,溶液中含有NH4+,非酸性条件下硝酸根没有强氧化性,不能与S2-反应,其它离子之间也不发生反应,可以大量共存,故A正确;
B.HCO3-与AlO2-发生水解反应反应生成氢氧化铝沉淀,不能大量共存;
C.HF为弱酸,酸性条件下不能大量存在F-,F-与Ca+生成CaF2沉淀,不能大量共存,故C错误;
D.能使紫色石蕊试液变红的溶液呈酸性,酸性条件下MnO4-、NO3-具有强氧化性,可以氧化Fe2+,不能大量共存,故D错误.
故选:A.
点评 本题考查离子共存,需要学生熟练掌握元素化合物性质,注意识记常见双水解反应的离子、强氧化性与还原性的微粒,注意一些隐含条件,如离子颜色、溶液pH、水电离氢离子或氢氧根离子浓度、能与Al反应生成氢气等.

练习册系列答案
相关题目
13.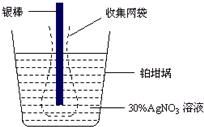 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
 精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )
精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量.实际测量中常用的银电量计结构如图所示,则下列说法正确的是( )| A. | 电量计中的银棒应与电源的正极相连,铂棒上发生的电极反应式为:2H++NO3-+e-=NO2↑+H2O | |
| B. | 已知每摩尔电子的电量为96 500 C,若反应进行10分钟,称量电解前后铂坩埚的质量变化值为108.0 mg,则电解过程中的平均电流约为9.65A | |
| C. | 若要测定电解精炼铜时通过的电量,可将银电量计中的银棒与待测电解池的精铜电极相连 | |
| D. | 实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂坩埚而导致测量误差,常在银电极附近增加一个收集网袋.若没有收集网袋,测量结果会偏低 |
10.下列电子式正确的是( )
| A. | H2O2 | B. | 羟基: | C. | 甲基: | D. | NH4Cl: |
7.下列说法不正确的是( )
| A. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 油脂皂化反应得到高级脂肪酸与甘油 | |
| C. | 用甘氨酸(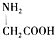 )和丙氨酸( )和丙氨酸(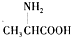 )的混合物在一定条件下可形成四种链状二肽 )的混合物在一定条件下可形成四种链状二肽 | |
| D. | 实验证实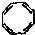 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 可使溴的CCl4溶液褪色,说明该分子中够存在碳碳双键 |
7.下列关于铷( Rb)的叙述中正确的是( )
| A. | 位于第四周期、第ⅠA 族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |