题目内容
14.钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3•xH2O),写出铁发生电化学腐蚀时正极的电极反应:2H2O+O2+4e-═4OH-.
(3)下列哪个装置可防止铁棒被腐蚀BD(填字母).

(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图,请回答:

①B电极对应的金属是铁 (写元素名称),A电极的电极反应式是Cu-2e-=Cu2+.
②若电镀前两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差12.8g.
分析 (1)一氧化碳具有还原性可以还原氧化铁生成铁和二氧化碳;
(2)铁发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子;
(3)根据金属生锈的条件以及原电池和电解池的工作原理知识来回答判断;
(4)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,根据电子与铜之间的关系计算.
解答 解:(1)一氧化碳具有还原性,一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)铁发生吸氧腐蚀,正极上氧气得电子生成氢氧根离子,则正极的反应式为:2H2O+O2+4e-═4OH-;
故答案为:2H2O+O2+4e-═4OH-;
(3)B装置中,金属铁做原电池的正极,被保护,不易生锈,D装置中,金属铁作阴极,被保护起来,C装置具备金属生锈的条件,A装置中,金属铁是原电池的负极,易被腐蚀,
故答案为:BD;
(4)①在铁件的表面镀铜,金属铜必须是阳极材料,金属铁为阴极,则B为铁,A为Cu失电子生成铜离子,其发生的电极反应:Cu-2e-=Cu2+,
故答案为:铁;Cu-2e-=Cu2+;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,
故答案为:12.8.
点评 本题考查了金属的冶炼、原电池、电解池知识,题目涉及方程式书写、电极反应式书写、有关电化学计算、金属的腐蚀与防护等,题目综合性较强,难度中等,注意把握原电池的工作原理以及金属的防护方法.

 阅读快车系列答案
阅读快车系列答案| A. | 加入水时,平衡向右移动,CH3COOH电离常数增大 | |
| B. | 加入少量CH3COONa固体,平衡向右移动 | |
| C. | 加入少量NaOH固体,平衡向右移动,c(H+)减小 | |
| D. | 加入少量pH=5的硫酸,溶液中c(H+)增大 |
(一)高炉炼铁过程中发生的主要反应为:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度B.移出部分CO2
C.加入合适的催化剂D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成1mol K2FeO4转移电子的物质的量是3mol.
 | 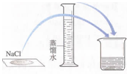 |  |  |
| A.接近称量质量时,轻振手腕,加够药品 | B.溶解时,用量筒控制所加蒸馏水的量 | C.移液时,玻璃棒插在刻度线以上,防止液体洒出 | D.接近刻度线1~2 cm时,用胶头滴管滴加蒸馏水至刻度线 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 所需仪器有:100mL容量瓶、烧杯、玻璃棒、胶头滴管、托盘天平 | |
| B. | 将量取的浓盐酸先倒入容量瓶,再加入蒸馏水至刻度线,摇匀 | |
| C. | 将溶液转移入容量瓶,要用玻璃棒引流 | |
| D. | 定容时仰视刻度,所配溶液浓度偏小 |
| A. | 某气体$\stackrel{通入品红溶液中}{→}$品红溶液褪色 结论:某气体一定是SO2 | |
| B. | 某气体$\stackrel{通入澄清石灰水}{→}$ 产生白色沉淀 结论:某气体一定是CO2 | |
| C. | 某溶液$\stackrel{打开瓶盖}{→}$冒白雾$\stackrel{将沾有浓氨水的玻璃棒靠近}{→}$ 白烟 结论:原溶液一定是浓盐酸 | |
| D. | 某溶液$\stackrel{滴加KSCN溶液液}{→}$ 血红色溶液 结论:原溶液中一定含有Fe3+ |
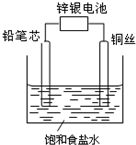 锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题:
锌银电池能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.锌银电池电解质溶液是KOH溶液,电池总反应为Zn+Ag2O═ZnO+2Ag.请回答下列问题: