题目内容
2.下列说法正确的是( )| A. | 淀粉、油脂、蛋白质等天然高分子化合物都可以水解 | |
| B. | 某容器内的物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| D. | 质子数为53,中子数为78的点原子可以表达为:${\;}_{53}^{78}$I |
分析 A、多糖、油脂和蛋白质均能发生水解;
B、只含一种元素的不一定是纯净物;
C、河水是胶体;
D、质量数=质子数+中子数.
解答 解:A、淀粉属于多糖,能水解生成单糖;油脂属于酯类,在酸性或碱性条件下能水解生成羧酸(羧酸盐)和醇(或酚);蛋白质能发生水解得到氨基酸,故A正确;
B、只含一种元素的不一定是纯净物,如氧气和臭氧的混合物,只含一种元素,但仍为混合物,故B错误;
C、河水是胶体,而海水中有大量的电解质,故在入海口处发生了胶体的聚沉从而形成三角洲,故C正确;
D、质量数=质子数+中子数,故此碘原子的质量数为131,故表示为:13153I,故D错误.
故选AC.
点评 本题考查了有机物的水解、纯净物和混合物的区分以及胶体的性质,应注意的是由一种物质构成的是纯净物,只含一种元素的不一定是纯净物.

练习册系列答案
相关题目
17.下列各组均是两瓶无标签的无色溶液,不使用其他任何试剂(包括水)也能鉴别出来的是( )
①NaOH和Al2(SO4)3
②Na2CO3和稀HCl
③Ba(OH)2和H2SO4
④HCl和NaAlO2.
①NaOH和Al2(SO4)3
②Na2CO3和稀HCl
③Ba(OH)2和H2SO4
④HCl和NaAlO2.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
14.在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180~200℃}^{50~80℃}$Ni(CO)4(g),△H<0.利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( )
| A. | 增加Ni的量可提高CO的转化率,Ni的转化率降低 | |
| B. | 缩小容器容积,平衡右移,△H减小 | |
| C. | 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 | |
| D. | 当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
11.硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:
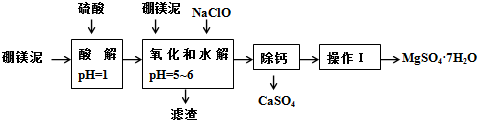
已知:某些氢氧化物沉淀的pH如表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70.0%.(保留两位有效数字)
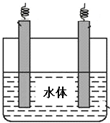
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注.

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎、或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O═MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70.0%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注.

12.下列离子方程式书写正确的是( )
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
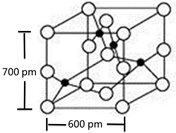 X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题:
X、Y、M、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子.请回答下列问题: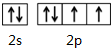 ;Z所在周期中第一电离能最大的主族元素是氯(元素名称)
;Z所在周期中第一电离能最大的主族元素是氯(元素名称)