��Ŀ����
����������һ�ָ���ȼ�ϣ�Ҳ��һ�ֿ���������ɫ��Դ��
��1��������ȼ����Ϊ285.8kJ/mol��д����ȼ�յ��Ȼ�ѧ����ʽ�� ��
��2��ʵ����1mol H2 ��1mol Cl2��ȫ��Ӧ�ų�184.6kJ����������֪1mol H2�����л�ѧ������ʱ��Ҫ����436kJ��������1mol Cl2�����л�ѧ��������Ҫ����243kJ����������1mol HCl�����л�ѧ������ʱ��Ҫ���� kJ��������
��3����֪2H2O��g���T2H2��g��+O2��g������H=+483.6kJ/mol
N2��g��+2O2��g���T2NO2����H=+67.8kJ/mol
3H2��g��+N2��g���T2NH3��g������H=-92.0kJ/mol
��1mol NH3��g�� ȼ������NO2��g����H2O��g���ķ�Ӧ�ȡ�H= ��
��1��������ȼ����Ϊ285.8kJ/mol��д����ȼ�յ��Ȼ�ѧ����ʽ��
��2��ʵ����1mol H2 ��1mol Cl2��ȫ��Ӧ�ų�184.6kJ����������֪1mol H2�����л�ѧ������ʱ��Ҫ����436kJ��������1mol Cl2�����л�ѧ��������Ҫ����243kJ����������1mol HCl�����л�ѧ������ʱ��Ҫ����
��3����֪2H2O��g���T2H2��g��+O2��g������H=+483.6kJ/mol
N2��g��+2O2��g���T2NO2����H=+67.8kJ/mol
3H2��g��+N2��g���T2NH3��g������H=-92.0kJ/mol
��1mol NH3��g�� ȼ������NO2��g����H2O��g���ķ�Ӧ�ȡ�H=
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,�йط�Ӧ�ȵļ���
ר�⣺
��������1������ȼ���ȸ�����1mol��ȼ����ȫȼ�������ȶ�������ų�������������д��
��2�����ݷ�Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣻
��3�������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
��2�����ݷ�Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣻
��3�������Ȼ�ѧ����ʽ��˹���ɼ��������Ȼ�ѧ����ʽ��
���
�⣺��1��������ȼ����Ϊ285.8kJ/mol����ָ1mol������ȫȼ������Һ̬ˮ�ų�����������������ȼ�յ��Ȼ�ѧ����ʽΪH2��g��+
O2��g��=H2O��l����H=-285.8 kJ?mol-1���ʴ�Ϊ��H2��g��+
O2��g��=H2O��l����H=-285.8 kJ?mol-1��
��2��ʵ����1mol H2��1mol Cl2��ȫ��Ӧ�ų�184.6kJ����������֪1mol H2�����л�ѧ������ʱ��Ҫ����436kJ��������1mol Cl2�����л�ѧ��������Ҫ����243kJ��������1mol HCl�����л�ѧ������ʱ��Ҫ��������x����Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͣ�-184.6KJ/mol=436KJ/mol+243KJ/mol-2x��x=431.8KJ/mol
��1mol HCl�����л�ѧ������ʱ��Ҫ����431.8kJ���ʴ�Ϊ��431.8kJ��
��3����2H2O��g���T2H2��g��+O2��g������H=+483.6kJ/mol
��N2��g��+2O2��g���T2NO2����H=+67.8kJ/mol
��3H2��g��+N2��g���T2NH3��g������H=-92.0kJ/mol
[����-�ۣ���2-�١�3]��
�õ�NH3��g��+
O2��g���TNO2 +
H2O��g����H=-282.8kJ/mol��
��1mol NH3��g��ȼ������NO2��g����H2O��g���ķ�Ӧ�ȡ�H=-282.8kJ/mol��
�ʴ�Ϊ��-282.8kJ/mol��
| 1 |
| 2 |
| 1 |
| 2 |
��2��ʵ����1mol H2��1mol Cl2��ȫ��Ӧ�ų�184.6kJ����������֪1mol H2�����л�ѧ������ʱ��Ҫ����436kJ��������1mol Cl2�����л�ѧ��������Ҫ����243kJ��������1mol HCl�����л�ѧ������ʱ��Ҫ��������x����Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͣ�-184.6KJ/mol=436KJ/mol+243KJ/mol-2x��x=431.8KJ/mol
��1mol HCl�����л�ѧ������ʱ��Ҫ����431.8kJ���ʴ�Ϊ��431.8kJ��
��3����2H2O��g���T2H2��g��+O2��g������H=+483.6kJ/mol
��N2��g��+2O2��g���T2NO2����H=+67.8kJ/mol
��3H2��g��+N2��g���T2NH3��g������H=-92.0kJ/mol
[����-�ۣ���2-�١�3]��
| 1 |
| 4 |
| 7 |
| 4 |
| 3 |
| 2 |
��1mol NH3��g��ȼ������NO2��g����H2O��g���ķ�Ӧ�ȡ�H=-282.8kJ/mol��
�ʴ�Ϊ��-282.8kJ/mol��
���������⿼�����Ȼ�ѧ����ʽ��д������˹���ɼ���Ӧ�ã�ע�����ü��ܼ����ʱ�ķ��������ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
����3������ٵ���Ȼ�����Һ �����ͺͲ��� �۱���ˮ����ȷ�ķ��뷽�������ǣ�������
| A����Һ����ȡ������ |
| B����ȡ������Һ |
| C����Һ��������ȡ |
| D��������ȡ����Һ |
���б仯�У���Ҫ�������������ǣ�������
| A��HCl��H2 |
| B��HCl��FeCl2 |
| C��H2SO4��Ũ����SO2 |
| D��Fe��Fe2O3 |
���и����������仯�������ķ�Ӧ������ͬһ���͵��ǣ�������
���ɼױ��Ƽ������顢����ϡ��������
����ϩʹ��ˮ��ɫ����Ȳʹ���Ը������ˮ��Һ��ɫ
���ɱ������������ɱ��Ʊ����ᣮ
���ɼױ��Ƽ������顢����ϡ��������
����ϩʹ��ˮ��ɫ����Ȳʹ���Ը������ˮ��Һ��ɫ
���ɱ������������ɱ��Ʊ����ᣮ
| A��ֻ�Тڢ� | B��ֻ�Т٢� |
| C��ֻ�Т٢� | D���٢ڢ� |
X��Y��Z��W��ԭ������������������ֶ�����Ԫ�أ��ס��ҡ������������������е����ֻ�����Ԫ����ɵĻ����������ZԪ���γɵĵ��ʣ���֪����+��=��+������+��=��+����0.1mol?L-1����Һ��c��OH-��=0.1mol?L-1������˵����ȷ���ǣ�������
| A��ԭ�Ӱ뾶��W��Z��Y��X |
| B��YԪ�������ڱ��е�λ��Ϊ�������ڵڢ�A�� |
| C��1 mol��������������ȫ��Ӧ��ת����1 mol���� |
| D��1.0 L 0.1 mol?L-1����Һ���������ܵ����ʵ���С��0.1 mol |
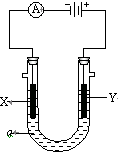 ���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺