题目内容
4.下列实验操作及现象结论描述不准确的是( )| A. | 向稀的苯酚水溶液中滴加少量稀溴水,先看到白色沉淀后沉淀消失,因为生成的三溴苯酚又溶于苯酚溶液中 | |
| B. | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 将实验室制乙烯的发生装置中制得的产物直接通入酸性高锰酸钾溶液,溶液褪色则说明乙烯有还原性 |
分析 A.三溴苯酚能溶于苯酚;
B.溶度积常数小的物质先产生沉淀;
C.中和热的测定中需要的实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计;
D.乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.根据相似相溶原理知,三溴苯酚能溶于苯酚,所以向稀的苯酚水溶液中滴加少量稀溴水,先看到白色沉淀后沉淀消失,故A正确;
B.溶度积常数小的物质先产生沉淀,向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,则说明KSP[Mg(OH)2]>KSP[Cu(OH)2],故B正确;
C.中和热的测定中需要的实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计,温度计测量溶液温度、环形玻璃搅拌棒搅拌溶液使溶液温度均匀,故C正确;
D.乙醇具有挥发性,生成的乙烯中含有乙醇,乙醇能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以应该将得到的气体先通入水中,然后再通入酸性高锰酸钾溶液中,故D错误;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及有机物的性质、溶度积常数大小比较、基本操作、物质检验等知识点,明确物质性质及实验原理是解本题关键,注意D中要排除乙醇的干扰,为易错点.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
14.化学深入我们的生活,下列相关说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | |
| B. | 开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 生活中常用的淀粉、蔗糖、葡萄糖的组成元素相同 |
15.中国将于2016年发射“天宫二号”空间实验室,“天宫二号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )

| A. | 有0.1mol电子转移时,a电极产生1.12LO2 | |
| B. | c极上发生还原反应,B中的H+可以通过隔膜进入A | |
| C. | b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- | |
| D. | d电极上发生的电极反应是:O2+4H++4e-=2H2O |
12. 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
 如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2═Fe+2Li2S.下列说法正确的是( )| A. | Li 发生氧化反应,a 极为阴极 | |
| B. | 电子由 a 极流出通过电流表流入 b 极,然后再由 b 极经内电路回到 a 极 | |
| C. | 可以用水代替 SO(CH3)2做溶剂 | |
| D. | b 极反应式是 FeS2+4Li++4e-═Fe+2Li2S |
19.下列实验能够达到实验目的是( )
| A. | 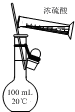 用如图装置配制100 mL 0.1 mol/L的硫酸 | |
| B. |  用如图装置提取碘水中碘 | |
| C. |  用如图装置制取少量乙烯气体 | |
| D. | 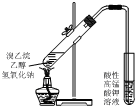 用如图装置验证溴乙烷发生消去反应 |
9.食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
表中数据:t1<t2(填“>”、“<”或“=”);表中V2=40mL.
已知:①氧化性:IO3->Fe3+>I2;还原性:S2O32->I-;②KI+I2?KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为4份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①向第四份试液中加K3Fe(CN)6溶液,根据是否得到具有特征蓝色的沉淀,可检验是否含有Fe2+(用离子符号表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为:IO3-+5I-+6H+=3I2+3H2O、2Fe3++2I-=2Fe2++I2.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失写出潮湿环境下KI与氧气反应的化学方程式:O2+4KI+2H2O=2I2+4KOH.
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质不适合作为食盐加碘剂,其理由是KI3在受热(或潮湿)条件下产生I2和KI,KI被氧气氧化,I2易升华.
(3)某同学为探究温度和反应物浓度对反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O的速率的影响,设计实验如下表所示:
| 0.01mol•L-1KIO3 酸性溶液(含淀粉) 的体积/mL | 0.01mol•L-Na2SO3 溶液的体积/mL | H2O的 体积/mL | 实验 温度 /℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t3 |
 .
.
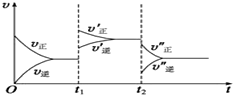 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为: