题目内容
1.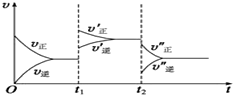 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:(1)反应①:t1时刻:v正大于v逆(填“大于”“小于”“等于”),
t2时刻:平衡向正反应方向移动,改变的条件为降低温度.
(2)反应②:t1时刻平衡向正反应方向移动,改变的条件为升高温度
t2时刻改变的条件为减小压强.
分析 (1)t1时刻正逆反应速率都增大,且正反应速率大于逆反应速率,对于①改变条件为增大压强;t2时刻正逆反应速率比t1时刻都减小,且反应正反应速率大于逆反应速率,平衡正向进行,依据影响化学反应速率的因素判断,对于①改变的条件为降低温度;
(2)图象可知正反应速率大于逆反应速率,平衡正向进行,正反应为吸热反应,正逆反应速率都增大,且平衡正向进行,对于反应②则t1时刻改变的条件应是升温,t2时刻正逆反应速率比t1时刻都减小,且反应正反应速率大于逆反应速率,平衡正向进行,t2时刻改变条件是减小压强.
解答 解:(1)对于①N2(g)+3H2(g)??2NH3(g)△H<0,反应是气体体积减小的放热反应,图象分析可知t1时刻正逆反应速率都增大,且正反应速率大于逆反应速率,依据影响化学反应速率的因素判断,改变条件为增大压强;t2时刻正逆反应速率比t1时刻都减小,且反应正反应速率大于逆反应速率,平衡正向进行,依据影响化学反应速率的因素判断改变的条件为降低温度,
故答案为:大于,正反应,降低温度;
(2)反应②2NH3(g)?N2(g)+3H2(g)△H>0,反应是气体体积增大的吸热反应,图象可知正反应速率大于逆反应速率,平衡正向进行,正反应为吸热反应,正逆反应速率都增大,且平衡正向进行则t1时刻改变的条件应是升高温度,t2时刻正逆反应速率比t1时刻都减小,且反应正反应速率大于逆反应速率,平衡正向进行,t2时刻改变条件是减小压强,
故答案为:正反应,升高温度,减小压强.
点评 本题考查了化学反应速率、化学平衡的影响因素分析判断,注意图象中速率改变的特征和反应特点,化学平衡移动原理和影响反应速率的因素分析是解题关键,题目难度中等.

练习册系列答案
相关题目
4.下列实验操作及现象结论描述不准确的是( )
| A. | 向稀的苯酚水溶液中滴加少量稀溴水,先看到白色沉淀后沉淀消失,因为生成的三溴苯酚又溶于苯酚溶液中 | |
| B. | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2] | |
| C. | 利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定 | |
| D. | 将实验室制乙烯的发生装置中制得的产物直接通入酸性高锰酸钾溶液,溶液褪色则说明乙烯有还原性 |
5.目前主要被用作肥料的无水氨如果稍加改进,就可以用在内燃机和氨燃料电池中,从而减轻对化石燃料的依赖.下列有关叙述中正确的是( )
| A. | 一旦将氨气用作燃料,将彻底解决能源危机 | |
| B. | 氨气燃烧的化学方程式可能为4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$4NO+6H2O | |
| C. | 比氢气更易储存,因为氨易液化 | |
| D. | 在氨燃料电池中,氨作正极 |
6.常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是(( )
| A. | c(H+) | B. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | C. | c(H+)•c(OH-) | D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$ |
13.已知0.1mol•L-1的醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,要使溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ 值减小,可以采取的措施是( )
| A. | 加水 | B. | 加少量冰醋酸 | C. | 降低温度 | D. | 加少量烧碱溶液 |
11.如图所示装置是“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中是否有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
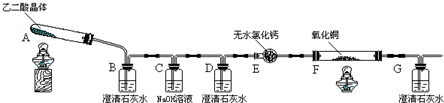
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
KMnO4溶液的物质的量浓度的计算式是c(KMnO4)=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.

(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳.
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊.
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊.
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量红色固体,滴加稀硫酸,观察红色固体是否有部分溶解,溶液是否变蓝色.
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4氧化生成CO2.KMnO4和草酸钠在稀硫酸中反应的离子方程式是:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |