题目内容
18.下列各物质所含原子数由多到少的顺序是( )①1.204×1024个C
②0.7mol NH3
③1.204×1023个钠原子
④0.2mol H2SO4
⑤1mol He.
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
分析 根据物质的量的公式计算C、钠的物质的量,再根据各物质的化学式计算各物质含有原子数目,进行比较,注意He为单原子分子.
解答 解:①1.204×1024个C的物质的量为n=$\frac{N}{{N}_{A}}$=2mol;
②由于氨气为四原子分子,故0.7mol NH3中含2.8mol原子;
③1.204×1023个钠原子的物质的量n=$\frac{1.204×1{0}^{23}}{{N}_{A}}$=0.2mol;
④由于硫酸中含7个原子,故0.2mol H2SO4中含1.4mol原子;
⑤由于氦气为单原子分子,故1mol He中含1mol原子.
根据计算可知,所含的原子个数由多到少的顺序是②①④⑤③,故选B.
点评 本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.

练习册系列答案
相关题目
6.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变为无色.下列分析正确的是( )
| A. | 滴加KI溶液时,当有2molI-参加反应,则生成1mol白色沉淀 | |
| B. | 通入SO2后溶液逐渐变成无色,体现了SO2的氧化性 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂,H2SO4是氧化产物 | |
| D. | 上述实验条件下,物质的还原性:Cu+>I->SO2 |
13.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
3.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4 与Zn反应产生的 Cu 与Zn形成铜锌原电池,加快了氢气产生的速率.
(3)实验室中现有Cu(NO3)2、FeSO4、AgNO3、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是FeSO4.
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度;适当增加硫酸的浓度(答两种).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
10.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金的性质的叙述中正确的是( )
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
10.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/L FeCl3溶液,0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为Fe2++Zn═Zn2++Fe.
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
11.下列方程式书写正确的是( )
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |

 .
. .
. 的有机物不能稳定存在)
的有机物不能稳定存在) .
.
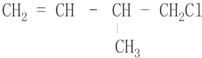
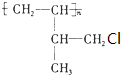 .
.