题目内容
11.下列方程式书写正确的是( )| A. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | KHCO3溶液与Al2(SO4)3溶液混合:3HCO3-+Al3+=Al(OH)3↓+3CO2↑ | |
| C. | 将过量铁粉加入到稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O | |
| D. | 碳酸电离:H2CO3=H++HCO3- |
分析 A、反应质量不守恒;
B、KHCO3溶液与Al2(SO4)3溶液混合后发生HCO3-和Al3+的双水解;
C、过量铁粉和稀硝酸反应生成Fe(NO3)2、NO和水;
D、碳酸为弱酸,电离不彻底.
解答 解:A、Na2O2固体与水反应生成氢氧化钠和氧气,离子方程式:2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B、KHCO3溶液与Al2(SO4)3溶液混合后发生HCO3-和Al3+的双水解,离子方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑,故B正确;
C、过量铁粉和稀硝酸反应生成Fe(NO3)2、NO和水,故离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,故C正确;
D、碳酸为弱酸,电离不彻底,故电离方程式为:H2CO3?H++HCO3-,故D错误.
故选BC.
点评 本题考查了离子方程式和电离方程式的书写,难度不大,应注意的是碳酸是弱酸,故电离应用可逆号.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
18.下列各物质所含原子数由多到少的顺序是( )
①1.204×1024个C
②0.7mol NH3
③1.204×1023个钠原子
④0.2mol H2SO4
⑤1mol He.
①1.204×1024个C
②0.7mol NH3
③1.204×1023个钠原子
④0.2mol H2SO4
⑤1mol He.
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
6.实验室需要450mL1mol/L的硫酸,现用密度为1.84g/cm3,溶质的质量分数98%的浓硫酸来配制,有关说法正确的是(设NA阿伏加德罗常数的值)( )
| A. | 浓硫酸中硫酸物质的量浓度为18.4 mol/L | |
| B. | 配制溶液所需浓硫酸体积为24mL | |
| C. | 配制溶液时仅需的仪器有容量瓶、烧杯、玻璃棒、量筒 | |
| D. | 配制溶液时,量取硫酸注入到烧杯中,加水稀释,冷却后再转移到容量瓶中 |
16.0.5L 1molL-1FeCl3溶液与0.1L 1molL-1MgCl2溶液中Cl-的数目之比( )
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
3.某电解质溶液的pH=a,向其中插入两惰性电极,通电一段时间后,测知溶液的pH=b.若b≤a,该电解质可能是( )
| A. | Na2S | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
20.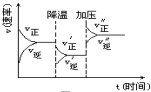 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |