题目内容
10.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/L FeCl3溶液,0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题.(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
分析 (1)亚铁离子居于中间价态,铁元素化合价由+2价升高为+3价表现还原性;
(2)探究亚铁离子具有还原性,依据图表中实验步骤,加入铁和氯化铁反应生成氯化亚铁溶液,加入硫氰酸钾溶液不变红色,证明无铁离子;
(3)锌和亚铁离子反应发生置换反应生成铁和锌离子;
(4)①已知MnO4-在反应中得到电子,依据氧化还原反应电子守恒,X为亚铁离子失电子发生氧化反应;
②高锰酸根离子具有氧化性在酸溶液这氧化亚铁离子为铁离子,本身被还原为锰离子.
解答 解:(1)依据分析可知:加入氧化剂氯水会氧化亚铁离子为铁离子,化学反应方程式为:2FeCl2+Cl2=2FeCl3;故答案为:2FeCl2+Cl2=2FeCl3;
(2)探究铁离子具有氧化性,依据图表中实验步骤,取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液,加入铁粉后,发生反应Fe+2FeCl3=3FeCl2,溶液颜色变为浅绿色,加入硫氰酸钾溶液不变红色,证明无铁离子,
故答案为:浅绿色;不变色;
(3)锌和亚铁离子反应发生置换反应生成铁和锌离子,反应的离子方程式为:Fe2++Zn═Zn2++Fe,
故答案为:Fe2++Zn═Zn2++Fe;
(4)①已知MnO4-在反应中得到电子,依据氧化还原反应电子守恒,元素化合价有升高和降低,所以判断X为亚铁离子失电子发生氧化反应,
故答案为:Fe2+;
②高锰酸根离子具有氧化性在酸溶液这氧化亚铁离子为铁离子,本身被还原为锰离子,反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
点评 本题考查铁及其化合物的性质实验,为高考常见题型,侧重考查离子性质和离子检验的实验方法设计和反应现象分析,离子方程式书写,这些知识点都是考查热点,也是学习重点,要求学生具有分析和解决问题的能力,难度不大.

①1.204×1024个C
②0.7mol NH3
③1.204×1023个钠原子
④0.2mol H2SO4
⑤1mol He.
| A. | ①③②④⑤ | B. | ②①④⑤③ | C. | ②④①⑤③ | D. | ④⑤②①③ |
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
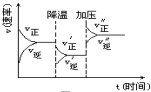 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
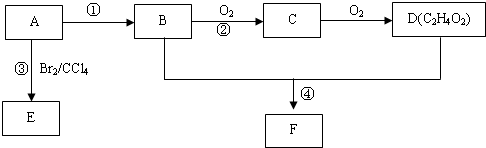
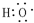 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.
 .
.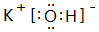 ;其中所含化学键的类型离子键、共价键.
;其中所含化学键的类型离子键、共价键.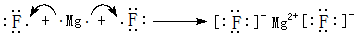 .
.