题目内容
下列各溶液中,一定能大量共存的是
A.Fe3+、Na+、SO42-、H2O2 B.C2H5OH、MnO4-、H+ 、K+
C.Pb2+、K+ 、SO42-、Cl-D.Na+、SO32- 、CH3COO-、S2-
D
【解析】
试题分析:A、过氧化氢在铁离子的存在下分解生成氧气和水,不能大量共存,错误;B、酸性条件下,高锰酸钾可以氧化乙醇,不能大量共存,错误;C、Pb2+与SO42-反应生成硫酸铅沉淀,不能大量共存,错误;D、四种离子都不反应,可以大量共存,正确,答案选D。
考点:考查离子大量共存的判断

(10分)聚合硫酸铁(SPFS)是一种新型的饮用水处理剂和城市污水净化剂,其化学组成可表示为[Fe2(OH)n(SO4)3 -  ]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
]m 。某研究小组将聚合硫酸铁在一定条件下加热完全分解,对所得气体产物和固体产物进行实验探究。请利用实验室常用仪器、用品和以下试剂完成验证和探究过程(已知SO3的熔点为16.8 ℃)。
试剂:1.0 mol·L-1的盐酸、1.0 mol·L-1的KMnO4溶液、 0.1 mol·L-1的BaCl2溶液、20%的KSCN溶液、品红溶液、蒸馏水、冰水。
(1)聚合硫酸铁中铁元素的化合价是________
(2)固体产物成分的探究
【实验设计】
实验步骤 | 现象 |
步骤1:取适量的固体产物于试管中,加入足量1.0 mol·L-1的盐酸,充分振荡使固体完全溶解。 | 固体溶解,没有观察 到气泡,溶液呈黄色 |
步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液振荡 | 溶液呈血红色 |
步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0 mol·L-1的KMnO4溶液,振荡。 | KMnO4的紫红色不褪去 |
【思考与判断】 根据上面的信息,可以确定固体产物的成分是________;
步骤1中发生反应的离子方程式为
(3)气体产物成分的探究(不考虑水蒸气)
【提出假设】 假设1:所得气体的成分是SO3 假设2:所得气体的成分是SO2、O2
假设3:所得气体的成分是
【设计实验方案,验证假设】按下表的实验步骤写出预期现象与结论。
实验操作 | 预期现象与结论 |
步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①
② |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1 mol·L-1的BaCl2溶液,充分振荡 | 结合步骤1中的②
|
实验室有五个药品柜,已经存放的药品如下表:
甲柜 | 乙柜 | 丙柜 | 丁柜 | 戊柜 |
盐酸、硫酸 | 烧碱、氢氧化钡 | 硫、红磷 | 铜、锌 | 碳酸钠、硝酸钾 |
现在新购进硝酸、苛性钾、碘和硝酸银溶液,下列对其保存方法不正确的是( )
A.硝酸装进棕色细口瓶放在甲柜 B.苛性钾固体用磨口玻璃塞广口瓶放在乙柜
C.碘单质用广口瓶装放在丙柜 D.硝酸银溶液用棕色磨口细口瓶放在戊柜




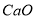 生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
生成的沉淀是_______,若通入的气体A少量则反应2的离子方程式为_____________。
