题目内容
8. 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的NaHCO3溶液的碱性大于NaClO溶液 | |
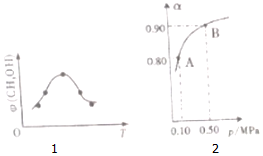
| B. | 图象中a点的导电能力小于c点 | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
分析 A、酸的电离常数越大,则酸根离子的水解程度越小;
B、自由移动离子浓度越大导电能力越强;
C、酸性越强,加水稀释时,pH变化越大;
D、先根据电离程度大小判断醋酸、次氯酸对应曲线及起始浓度大小,a、b两点加入水的体积相同,则此时酸溶液浓度取决于酸的起始浓度.
解答 解:A、碳酸的第一步的电离常数大于次氯酸,所以次氯酸钠的水解程度大于碳酸氢钠,相同浓度的NaHCO3溶液的碱性小于NaClO溶液,故A错误;
B、图象中a点到c点,溶剂水的量增加,电离程度变大,但加水导致溶液体积变大,自由移动离子的浓度减小,所以a点的导电能力大于c点,故B错误;
C、稀释CH3COOH、HClO两种酸的稀溶液时,CH3COOH的酸性强,加水稀释时CH3COOH的pH变化大,所以图象 I代表CH3COOH溶液的稀释,故C正确;
D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,故D错误.
故选C.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.

练习册系列答案
相关题目
3.下列关于钠的化合物的说法中,正确的是( )
| A. | Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应 | |
| B. | NaHCO3固体中混有的Na2CO3可用加热的方法除去 | |
| C. | Na2O2和Na2O中阴阳离子个数比均为1:2 | |
| D. | 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 |
13.下列方法,能达到实验目的是( )
| A. | 通过蒸馏,分离苯和硝基苯的混合物 | |
| B. | 电解AlCl3,可得金属铝 | |
| C. | 将MgCl2溶液蒸干,可得无水MgCl2 | |
| D. | 用过滤的方法,从碘水中提取碘 |
20.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Na+、NO3-、MnO4- | B. | Mg2+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、Br-、S2- | D. | NH4+、Al3+、Ac-、NO3- |
17.不属于合金的物质是 ( )
| A. | 生铁 | B. | 硬铝 | C. | 水银 | D. | 青铜 |
 .
. 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H