题目内容
19. 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是BC.
A.CO2和CH3OH的浓度相等 B.H2的百分含量保持不变
C.容器内压强保持不变 D.3v正(H2)=v逆(H2O)
E.容器中混合气体的密度保持不变
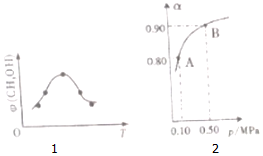
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数 ?(CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的△H<0(填“>”、“<”、“=”)
(3)上述反应在实际生产中采用的温度是300℃,其目的是加快反应速率,使催化剂活性较高.
(4)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(a)与体系总压强(P)的关系如图2所示.回答问题:
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是CD.
A.CO2的浓度减小 B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3 D.H2的体积分数减小
②B点平衡混合气体的平均摩尔质量为22.7g/mol(保留一位小数).
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(2)由图可知,到达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行;
(3)采用300℃的温度,可以加快反应速率,且催化剂活性较高;
(4)①A.体积压缩,反应混合物各组分浓度均增大;
B.体积压缩,压强增大,正、逆反应速率都增大;
C.CO和H2按1:3的体积比投入,且二者按物质的量1:3反应,反应体系中CO2和H2的体积比始终为1:3;
D.压缩体积,增大压强,平衡正向移动,H2的体积分数减小;
②由CO2与H2按1:3的体积比,设二氧化碳的物质的量为1mol,则氢气的物质的量为3mol,而平衡时CO2的平衡转化率90%,根据三行式分析解答.
解答 解:(1)A.CO2和CH3OH的浓度相等,并不是不变,所以不能说明达平衡状态,故错误;
B.H2的百分含量保持不变,说明各物质的量不变,反应达平衡状态,故正确;
C.容器内压强保持不变,说明气体的总物质的量不变,反应达平衡状态,故正确;
D.达平衡时应有:v正(H2)=3v逆(H2O),故错误;
E.容器中混合气体的密度一直保持不变,故错误;
故选:BC;
(2)由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,
故答案为:<;
(3)采用300℃的温度,可以加快反应速率,且催化剂活性较高,
故答案为:加快反应速率,使催化剂活性较高;
(4)①A.体积压缩,反应混合物各组分浓度均增大,故A错误;
B.体积压缩,压强增大,正、逆反应速率都增大,故B错误;
C.CO和H2按1:3的体积比投入,且二者按物质的量1:3反应,反应体系中CO2和H2的体积比始终为1:3,故C正确;
D.压缩体积,增大压强,平衡正向移动,H2的体积分数减小,故D正确,
故选:CD;
②由CO2与H2按1:3的体积比,设二氧化碳的物质的量为1mol,则氢气的物质的量为3mol,而平衡时CO2的平衡转化率90%,
CO2(g)+3H2(g)→CH3OH(g)+H2O(g)
初起量:1mol 3mol 0 0
变化量:0.9mol 2.7mol 0.9mol 0.9mol
平衡量:0.1mol 0.3mol 0.9mol 0.9mol
所以B点平衡混合气体的平均摩尔质量为:$\frac{44+6}{2.2}$=22.7g/mol,故答案为:22.7g/mol.
点评 本题考查化学平衡状态、化学平衡计算与影响因素等知识点,难度中等,注意三行式在化学平衡计算中的应用.

| A. | 用乙醇萃取溴水中的溴单质可选用分液漏斗 | |
| B. | 为了保证冷凝效果,蒸馏操作时冷凝水流向要与蒸馏水流动方向相同 | |
| C. | 蒸馏操作时温度计的水银球要与圆底烧瓶的支管口相平 | |
| D. | 分液时,需将分液漏斗上口的塞子打开或使玻璃凹槽和小孔连通 |
| A. | 2-甲基丙烷 | B. | 环戊烷 | ||
| C. | 2,2,3,3-四甲基丁烷 | D. | 3-甲基戊烷 |
| A. | 18gH2O所含电子数为10NA | |
| B. | 常温常压下,48gO3和O2含氧原子数目3NA | |
| C. | 1molNa2O2所含阴离子数目为NA | |
| D. | 11.2L氢气中所含原子数为NA |
| A. | K 越大,反应物的转化率越小 | B. | K 与温度一定有关 | ||
| C. | K 与生成物的浓度一定有关 | D. | K 与反应物的浓度一定有关 |
| A. | 向(NH4)2Fe(SO4)2溶液中加入过量氢氧化钠:NH4++Fe2++30H-=NH3•H2O+Fe(OH)2↓ | |
| B. | 向明矾溶液中滴加Ba(0H)2溶液至SO42- 恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 向澄清石灰水中加入过量碳酸氢钠溶液:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| D. | 向酸性FeC12溶液中加入H2O2:2Fe2++2H2O2=2Fe3++O2↑+2H2O |
 已知:下表为25℃时某些弱酸的电离平衡常数.
已知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 25℃时,相同浓度的NaHCO3溶液的碱性大于NaClO溶液 | |
| B. | 图象中a点的导电能力小于c点 | |
| C. | 图象 I代表CH3COOH溶液的稀释 | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
| A. | 碘水、淀粉溶液 | B. | 溴水、四氯化碳 | ||
| C. | 盐酸、氯化钡溶液 | D. | 硝酸银溶液、稀硝酸 |
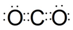 ;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.
;该化合物熔沸点低于CS2的原因是两者都为分子晶体,且结构相似,CS2式量大于CO2,CS2范德华力大,故CS2熔沸点高于CO2.