题目内容
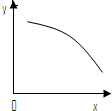 在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )
在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )| A、当x表示温度时,y表示NO物质的量 |
| B、当x表示反应时间时,y表示混合气体的密度 |
| C、当x表示压强时,y表示NO2的转化率 |
| D、当x表示NO2物质的量时,y表示O2的物质的量 |
考点:转化率随温度、压强的变化曲线,体积百分含量随温度、压强变化曲线
专题:化学平衡专题
分析:由图象可知,随着X的增大,Y的值减小:
A、从反应吸热,升高温度,平衡向正反应方向移动来分析;
B、达到平衡后,因混合气体的质量和体积不变,混合气体的密度不变;
C、从增大压强,平衡向逆反应方向移动分析;
D、增加NO2的物质的量时,相当于增大体系压强,平衡向逆方向移动,O2的物质的量减小.
A、从反应吸热,升高温度,平衡向正反应方向移动来分析;
B、达到平衡后,因混合气体的质量和体积不变,混合气体的密度不变;
C、从增大压强,平衡向逆反应方向移动分析;
D、增加NO2的物质的量时,相当于增大体系压强,平衡向逆方向移动,O2的物质的量减小.
解答:
解:A、反应吸热,升高温度,平衡向正反应方向移动,NO的物质的量增大,故A错误;
B、达到平衡后,因混合气体的质量和体积不变,混合气体的密度不变,故B错误;
C、增大压强,平衡向逆反应方向移动,NO2的转化率减小,故C正确;
D、增加NO2的物质的量时,相当于增大体系压强平衡向逆方向移动,O2的物质的量减小,图象符合,故D正确;
故选CD.
B、达到平衡后,因混合气体的质量和体积不变,混合气体的密度不变,故B错误;
C、增大压强,平衡向逆反应方向移动,NO2的转化率减小,故C正确;
D、增加NO2的物质的量时,相当于增大体系压强平衡向逆方向移动,O2的物质的量减小,图象符合,故D正确;
故选CD.
点评:本题考查化学平衡的影响因素,本题难度不大,注意外界条件对化学平衡的影响,特别是题中反应的特征.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列叙述正确的是( )
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7,c(SO42-)=c(NH4+) | ||
| B、两种醋酸溶液物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | ||
| C、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | ||
D、向0.1moL?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A、NA个氯气分子与NA个氢气分子的质量比等于35.5:1 |
| B、在常温常压下,11.2 L氯气含有分子数为0.5 NA |
| C、与7.8 g Na2O2完全反应时,消耗H2O的分子数为0.2 NA |
| D、1 L 0.5 mol?L-1硝酸钡溶液中所含NO3-数为0.5 NA |
已知:①lmolH2分子中化学键断裂时需要吸收436kJ的能量②1mol C12分子中化学键断裂时需要吸收243kJ的能量③由H原子和C1原子形成l mol HCl分子时释放431kJ的能量下列叙述中正确的是( )
| A、氢气和氯气反应生成氯化氢气体的热化学方程式是:H2(g)+Cl2(g)=2HCl(g)△H=366KJ?mol-1 |
| B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=366KJ?mol-1 |
| C、氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183KJ?mol-1 |
| D、氢气和氯气反应生成1 mol氯化氢气气体,反应的△H=-183KJ?mol-1 |
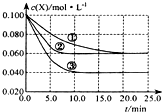 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
下列有关说法正确的是( )
| A、晶体析出规则是晶格能高的晶体最后析出 |
| B、铜型和钾型都是密置层堆积方式 |
| C、邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点高 |
| D、在干冰晶体中,每一个CO2周围有12个紧邻的CO2分子 |
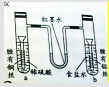 某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )
某同学为了探究金属腐蚀的原理,设计了如图装置,U型管内为红墨水,a、b试管内分别盛有稀硫酸和NaCl溶液,然后分别浸入末端缠有铜丝和铝丝的铁钉,放置一段时间,下列有关描述错误的是( )| A、a、b中负极反应式均是:Fe-2e═Fe2+ |
| B、红墨水柱两边的液面变为左低右高 |
| C、a中铁钉上发生了氧化反应,b中铁钉上发生还原反应 |
| D、a中铜丝附近有气泡产生,b中有白色沉淀产生 |



