题目内容
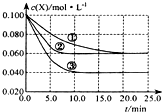 溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
溶液中的反应:X+Y?2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如图所示.②、③与①比较只有一个实验条件不同,下列说法不正确的是( )| A、前5min实验③的平均反应速率最快 |
| B、条件②的反应最先达到平衡 |
| C、②与①比较可能是压强更大 |
| D、该反应的正反应是吸热反应 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:与①比较,②反应速率增大,但与①处于同一平衡状态,则②应为加入催化剂,与①比较,③反应速率增大,x的平衡浓度降低,平衡向正反应方向移动,则为升高温度,据此分析解答.
解答:
解:A.根据v=
知,反应进行到5min时实验③浓度变化最大,所以③的反应速率最快,故A正确;
B.根据图象知,条件②的反应最先达到平衡,故B正确;
C.因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂,故C错误;
D.与①比较,③反应速率增大,x的平衡浓度降低,平衡向正反应方向移动,则为升高温度,升高温度,X的浓度减小,则平衡向正反应方向移动,所以正反应是吸热反应,故D正确.
故选C.
| △c |
| △t |
B.根据图象知,条件②的反应最先达到平衡,故B正确;
C.因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂,故C错误;
D.与①比较,③反应速率增大,x的平衡浓度降低,平衡向正反应方向移动,则为升高温度,升高温度,X的浓度减小,则平衡向正反应方向移动,所以正反应是吸热反应,故D正确.
故选C.
点评:本题考查化学平衡图象题,题目难度中等,注意分析曲线的变化特点,把握影响化学平衡以及反应速率的因素,注意该反应是在溶液中进行的反应,为易错点.

练习册系列答案
 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
烧碱、醋酸和醋酸钠等是生活中的常见物质.下列有关它们的表述正确的是( )
| A、将烧碱逐滴加入醋酸溶液中至溶液呈中性,则该混合液中还有少量醋酸未被中和 |
| B、将0.1 mol?L-1 CH3COOH溶液加水稀释,在此过程中,醋酸的电离程度、H+浓度都逐渐增大 |
| C、将醋酸逐滴加入醋酸钠溶液中至溶液呈酸性,则该溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、常温下,将pH=12的烧碱溶液与pH=2的醋酸溶液等体积混合,所得混合液的pH>7 |
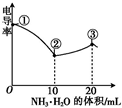 电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A、①点溶液中:c(H+)=0.200 mol?L-1 |
| B、溶液温度:①>③>② |
| C、③点溶液中:c(Cl-)>c(CH3COO-) |
| D、③点后因离子数目减少使溶液的电导率略降低 |
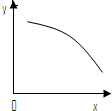 在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )
在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )| A、当x表示温度时,y表示NO物质的量 |
| B、当x表示反应时间时,y表示混合气体的密度 |
| C、当x表示压强时,y表示NO2的转化率 |
| D、当x表示NO2物质的量时,y表示O2的物质的量 |
在一定体积的密闭容器中,进行如下的化学反应CO2(g)+H2(g)?CO(g)+H2O(g),其中
=K,K被称为化学平衡常数,其中K和温度的关系如下表:根据以上信息推断以下说法正确的是( )
| [CO]×[H20] |
| [CO2]×[H2] |
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、此反应为放热反应 |
| B、此反应只有达到平衡时,密闭容器中的压强才不会变化 |
| C、此反应达到1000℃时的反应速率比700℃时大 |
| D、该反应的化学平衡常数越大,反应物的转化率越低 |
在一定温度下,足量的Zn与稀H2SO4反应,为了加快反应进行的速率,但又不影响生成H2的总量,不能向反应溶液中适量加入的物质是( )
| A、CH3COONa固体 |
| B、水 |
| C、K2SO4溶液 |
| D、CuSO4固体 |
下列叙述中,正确的是( )
| A、在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B、在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C、在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高 |
D、某基态原子错误的核外电子排布图为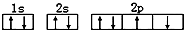 该排布图违背了泡利原理 该排布图违背了泡利原理 |
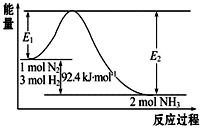 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题: