题目内容
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
| A、NA个氯气分子与NA个氢气分子的质量比等于35.5:1 |
| B、在常温常压下,11.2 L氯气含有分子数为0.5 NA |
| C、与7.8 g Na2O2完全反应时,消耗H2O的分子数为0.2 NA |
| D、1 L 0.5 mol?L-1硝酸钡溶液中所含NO3-数为0.5 NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.分子数相同则气体的物质的量相等,根据m=nM可知,气体的质量与摩尔质量成正比;
B.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量;
C.过氧化钠与水按照物质的量1:1反应生成氢氧化钠和氧气;
D.硝酸钡的浓度为0.5mol/L,则硝酸根离子浓度为1mol/L.
B.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量;
C.过氧化钠与水按照物质的量1:1反应生成氢氧化钠和氧气;
D.硝酸钡的浓度为0.5mol/L,则硝酸根离子浓度为1mol/L.
解答:
解:A.NA个氯气分子与NA个氢气分子具有相同的物质的量,根据m=nM可知,二者的质量比等于:71g/mol:2g/mol=35.5:1,故A正确;
B.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量,故B错误;
C.7.8 g Na2O2的物质的量为0.1mol,0.1mol过氧化钠完全反应消耗0.1mol水,消耗H2O的分子数为0.1NA,故C错误;
D.0.5 mol?L-1硝酸钡溶液中硝酸根离子浓度为1mol/L,1L该溶液中含有1mol硝酸根离子,所含NO3-数为NA,故D错误;
故选A.
B.不是标准状况下,不能使用标况下的气体摩尔体积计算11.2L氯气的物质的量,故B错误;
C.7.8 g Na2O2的物质的量为0.1mol,0.1mol过氧化钠完全反应消耗0.1mol水,消耗H2O的分子数为0.1NA,故C错误;
D.0.5 mol?L-1硝酸钡溶液中硝酸根离子浓度为1mol/L,1L该溶液中含有1mol硝酸根离子,所含NO3-数为NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度浓度应满足的关系是( )
| A、c(M+)>c(A-)>c( OH-)>c(H+) |
| B、c(M+)>c(A-)>c(H+)>c( OH-) |
| C、c(M+)>c( OH-)>c(A-)>c(H+) |
| D、c(M+)>c(H+)=c( OH-)>c(A-) |
硬铝合金包括Al-Cu-Mg系和Al-Cu-Mn系合金,广泛用于现代社会.下面关于硬铝的说法,错误的是( )
| A、强度跟铝相比有很大的提高,在某些性能上相当于钢材 |
| B、密度较小,只有钢材的三分之一左右,适用于做飞行器、火箭、卫星、导弹等 |
| C、熔点和铝相比有一定的提高,常被用于制造家庭使用的炊具 |
| D、抗腐蚀性能较强,常被建筑行业用作材料以及门窗框架 |
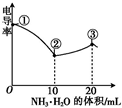 电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1 的HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )| A、①点溶液中:c(H+)=0.200 mol?L-1 |
| B、溶液温度:①>③>② |
| C、③点溶液中:c(Cl-)>c(CH3COO-) |
| D、③点后因离子数目减少使溶液的电导率略降低 |
下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是( )
| A、HCl、CaCO3、SO2 |
| B、KNO3、CH3COOH、NH3 |
| C、HClO、H2S、C2H5OH |
| D、BaSO4、H3PO4、H2O |
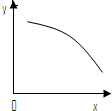 在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )
在一定条件下,固定容积的密闭容器中反应:2NO2(g)?O2(g)+2NO(g)△H>0,达到平衡.当改变其中一个条件x,y随x变化符合图中曲线的是( )| A、当x表示温度时,y表示NO物质的量 |
| B、当x表示反应时间时,y表示混合气体的密度 |
| C、当x表示压强时,y表示NO2的转化率 |
| D、当x表示NO2物质的量时,y表示O2的物质的量 |
在一定温度下,足量的Zn与稀H2SO4反应,为了加快反应进行的速率,但又不影响生成H2的总量,不能向反应溶液中适量加入的物质是( )
| A、CH3COONa固体 |
| B、水 |
| C、K2SO4溶液 |
| D、CuSO4固体 |
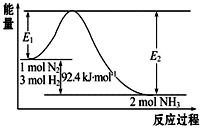 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ?mol-1,能量变化如图所示,回答下列问题: