题目内容
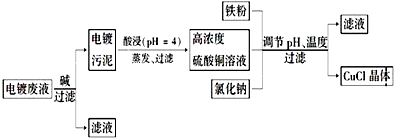
17.某反应过程中体系的能量变化如图所示,下列说法中错误的是( )
| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
分析 由图可知反应物总能量大于生成物总能量,则正反应放热,反应物的键能总和比生成物的键能总和低,反应热△H=E1-E2,其中E1和E2为反应的活化能,A…B…C为中间产物,为过渡态,可认为活化分子,催化剂改变化学反应速率是降低了反应的活化能,以此解答该题.
解答 解:A.由图可知反应物总能量大于生成物总能量,则正反应放热,反应物的键能总和比生成物的键能总和低,故A错误;
B.反应物吸收一定能量成为活化分子,E1为正反应的活化能,故B正确;
C.正反应的热效应为△H=E1-E2,反应物总能量大于生成物总能量,则正反应放热,故C正确;
D.使用合适的催化剂能同时降低E1和E2,但反应热不变,故D正确;
故选A.
点评 本题考查了化学反应的能量变化分析,催化剂的作用实质,图象识别和理解含义是解题关键,难度不大.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
7.下列化合物分子的核磁共振氢谱中氢原子的吸收峰只有一种的是( )
| A. | CH3OCH3 | B. | CH3CH2OH | C. | CH3CH2CH3 | D. | CH3COCH2CH3 |
8.下列说法正确的是( )
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
5.A、B、C、D、E是元素周期表中前18号元素,原子序数依次增大,他们可组成离子化合物C2B和共价化合物DB3、AE4,已知B、D同主族,C、D、E同周期.下列说法不正确的是( )
| A. | 原子半径C>D>E | |
| B. | A2E6分子中各原子均满足8电子结构 | |
| C. | 气态氢化物的稳定性HmE>HnD | |
| D. | B、C形成的化合物中只可能存在离子键 |
9.下列各组中的离子,能够大量共存于同一溶液中的是( )
| A. | H+、Na+、NO3-、CO32- | B. | H+、Na+、ClO-、Cl- | ||
| C. | K+、HCO3-、Cl-、OH- | D. | Na+、Mg2+、NO3-、SO42- |
14.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
| A. | 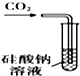 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 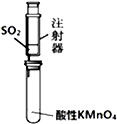 乙装置:可用来检验二氧化硫气体 | |
| C. | 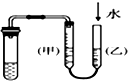 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. |  丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |