题目内容
17.硫的含氧酸及含氧酸盐的种类较多,这些物质在工业生产中具有较为广泛的用途.回答下列问题:(1)连二亚硫酸钠(Na2S2O4)用于纺织工业的还原性染色及丝、毛、尼龙等织物的漂白,还可用于肥皂、竹器、瓷土的漂白等.
①H2S2O4中,S的化合价为+3价;
②连二亚硫酸是一种二元弱酸,其第一步电离的电离常数表达式Ka=$\frac{c(H{S}_{2}{{O}_{4}}^{-})c({H}^{+})}{c({H}_{2}{S}_{2}{O}_{4})}$;
③连二亚硫酸钠暴露于空气中易吸收氧气和潮气而被氧化,且氧化产物随着O2的量不同而不同,当O2足量时,被完全氧化为NaHSO4,反应的化学方程式为2Na2S2O4+3O2+2H2O=4NaHSO4 ;若生成物NaHSO3:NaHSO4的物质的量之比为13:1时,该反应的氧化剂与还原剂的物质的量之比为4:7.
(2)过硫酸钾(K2S2O8)可用作漂白剂、强氧化剂、照相药品、分析试剂等.电解含硫酸、硫酸铵的电解液可制备H2S2O8,其与硫酸铵反应生成(NH4)2S2O8,再加入K2SO4可制得K2S2O8.
①电解含硫酸、硫酸铵的电解液时阳极反应式为2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+);
②电解过程中发生反应:(NH4)2SO4+H2S2O8=(NH4)2S2O8+H2SO4,电解后加入K2SO4发生的反应为(NH4)2S2O8+K2SO4+H2SO4=K2S2O8+2NH4HSO4,然后经冷却、分离、结晶、干燥,制得过硫酸钾成品.后者能发生的原因是K2S2O8溶解度小于(NH4)2S2O8、K2SO4的溶解度.
分析 (1)①根据化合价代数和为0分析;
②连二亚硫酸是一种二元弱酸,其第一步电离方程式为H2S2O4?HS2O4-+H+,据此书写电离常数表达式Ka;
③Na2S2O4易吸收氧气和潮气而被氧化,当O2足量时,被完全氧化为NaHSO4,原子守恒配平书写化学方程式,若生成物NaHSO3:NaHSO4的物质的量之比为13:1时,依据电子守恒计算氧化剂与还原剂的物质的量之比;
(2)①电解池中阳极SO42-发生氧化反应,阴极H+放电发生还原反应;
②电解后加入K2SO4发生的反应为(NH4)2S2O8+K2SO4+H2SO4=K2S2O8+2NH4HSO4,然后经冷却、分离、结晶、干燥,制得过硫酸钾成品是利用反应前后物质溶解度不同分析.
解答 解:(1)①因为Na为+1价,O为-2价,根据化合价代数和为0,则S为+3价,故答案为:+3;
②连二亚硫酸是一种二元弱酸,其第一步电离方程式为H2S2O4?HS2O4-+H+,据此书写电离常数表达式Ka=$\frac{c(H{S}_{2}{{O}_{4}}^{-})c({H}^{+})}{c({H}_{2}{S}_{2}{O}_{4})}$,故答案为:$\frac{c(H{S}_{2}{{O}_{4}}^{-})c({H}^{+})}{c({H}_{2}{S}_{2}{O}_{4})}$;
③Na2S2O4易吸收氧气和潮气而被氧化,当O2足量时,被完全氧化为NaHSO4,原子守恒配平书写化学方程式为:2Na2S2O4+3O2+2H2O=4NaHSO4,若生成物NaHSO3:NaHSO4的物质的量之比为13:1时,反应的化学方程式为:7Na2S2O4+4O2+7H2O=13NaHSO3+NaHSO4,依据化学方程式和电子守恒计算氧化剂与还原剂的物质的量之比为:4:7,
故答案为:2Na2S2O4+3O2+2H2O=4NaHSO4 ;4:7;
(2)①阳极失电子化合价升高:2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+),阴极H+放电;
故答案为:2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+);
②电解后加入K2SO4发生的反应为(NH4)2S2O8+K2SO4+H2SO4=K2S2O8+2NH4HSO4,然后经冷却、分离、结晶、干燥,制得过硫酸钾成品.此反应能发生的原因是K2S2O8溶解度小于(NH4)2S2O8、K2SO4的溶解度,会析出晶体,
故答案为:K2S2O8溶解度小于(NH4)2S2O8、K2SO4的溶解度.
点评 本题考查了含硫物质性质、化学方程式书写、氧化还原反应电子守恒计算、电解原理应用等知识点,注意题干信息分析,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 利用地沟油制肥皂的实验中,可以用玻璃棒蘸取反应液滴入有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中的地沟油已完全皂化 | |
| B. | 制备硝基苯,混合药品的先后顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| C. | 除去溴乙烷中的少量溴:加入Na2SO3溶液,振荡,静置分层后,除去水层 | |
| D. | 实验室受酸腐蚀时的处理:先用大量水冲洗,再用饱和碳酸氢钠溶液或肥皂水洗,最后再用水冲洗 |
| A. | b、c与a形成化合物的稳定性一定为b>c | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c,a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
| 溶液中溶质质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的密度/(克/厘米3) | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度/(克/厘米3) | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
(2)向200毫升28%的氨水中加入240毫升水,摇匀,所得溶液体积是多少毫升?(结果保留一位小数)
| A. | 2SO2+O2?2SO3 | B. | CO+H20(气)?CO2+H2 | ||
| C. | CO2+H2O?H2CO3 | D. | NaOH+HCl=NaCl+H20 |
| A. | ⑤②④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ②④⑤①③ |
| A. | 碱金属单质的熔、沸点逐渐降低 | B. | 卤素单质的熔、沸点逐渐降低 | ||
| C. | 碱金属单质的密度逐渐增大 | D. | 卤素单质的密度逐渐减小 |
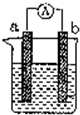 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: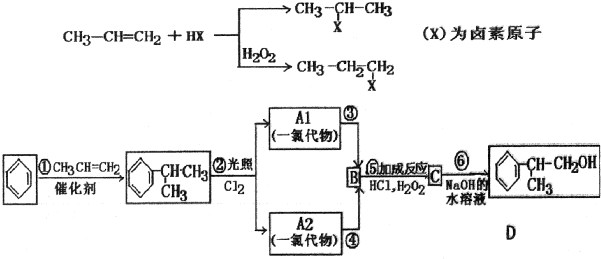
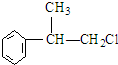 、,
、,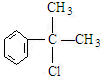 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaCl;
+NaCl;